题目内容
6.用下列实验装置进行相应的实验,能达到实验目的是( )| A. | 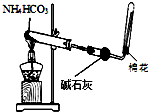 图装置用于制取少量的氨气 | |
| B. | 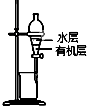 图装置用于提取I2的CCl4溶液中的I2 | |
| C. | 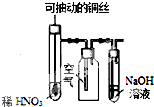 图装置微热稀HNO3,在广口瓶中可收集NO气体 | |
| D. | 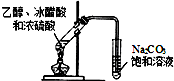 图装置可制取少量的乙酸乙酯 (夹持物略) |
分析 A.碳酸氢钠分解生成二氧化碳、水、氨气,碱石灰可吸水水、二氧化碳;
B.碘易溶于四氯化碳;
C.NO与氧气反应生成二氧化氮;
D.应防止倒吸.
解答 解:A.碳酸氢钠分解生成二氧化碳、水、氨气,碱石灰可吸水水、二氧化碳,生成的氨气密度比空气小,可用向下排空法收集,故A正确;
B.碘易溶于四氯化碳,溶液不分层,应用蒸馏的方法分离,故B错误;
C.NO与氧气反应生成二氧化氮,不能得到NO,故C错误;
D.乙醇、乙酸易溶于水,应防止倒吸,故D错误.
故选A.
点评 本题考查化学实验方案的评价,涉及混合物的分离、除杂、气体的收集、气体的制取等,侧重气体的制备实验考查,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 只含有一种元素的物质一定是纯净物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 石墨转变为金刚石为化学变化 | |
| D. | 水很稳定是因为水分子间存在较强的分子间作用力 |
17.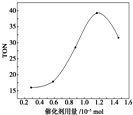 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5 mol时,该反应的TON达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
14.用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+).对该混合溶液的下列判断正确的是( )
| A. | c(OH-)>c(H+) | B. | c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1 | ||
| C. | c(CH3COOH)>c(CH3COO- ) | D. | c(CH3COO- )+c(OH- )=0.2 mol•L-1 |
1.在容积固定的密闭容器中发生反应:2NO+O2?2NO2,不能判断该反应达到到平衡状态的是( )
| A. | 单位时间内生成nmolO2的同时,生成2nmolNO2 | |
| B. | NO2?NO?O2反应速率的比为2:2:1 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的压强不再改变的状态 |
11.在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),下列叙述能说明该反应达到化学平衡状态的是( )
| A. | 容器中总压强不再随时间而变化 | |
| B. | v正(B)=0.03mol/(L•s),v逆(D)=1.2mol/(L•min) | |
| C. | 单位时间内断裂一个A-A键,同时生成两个C-C键 | |
| D. | 容器中混合气体的密度不再随时间而变化 |
18. 我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
 我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为:4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )| A. | 铝板是电池的正极 | |
| B. | 电池工作时铝板逐渐被消耗 | |
| C. | 电池工作时实现了化学能向电能的转化 | |
| D. | 将铂电极做成网状,可增大与氧气的接触面积 |
15.应用所学知识判断,下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | CO2、NO2或SO2都会导致酸雨的形成 | |
| C. | NH3液化时放出大量的热,因此,氨常用作制冷剂 | |
| D. | 活性炭、SO2、Na2O2都能使品红溶液褪色,原理相同 |