题目内容
16.下列说法正确的是( )| A. | 只含有一种元素的物质一定是纯净物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 石墨转变为金刚石为化学变化 | |
| D. | 水很稳定是因为水分子间存在较强的分子间作用力 |
分析 A.混合物中可能只含一种元素;
B.离子化合物中可能存在共价键;
C.石墨转变为金刚石,有新物质生成;
D.稳定性与化学键有关.
解答 解:A.混合物中可能只含一种元素,如氧气与臭氧的混合物,故A错误;
B.离子化合物中可能存在共价键,如NaOH中含离子键和共价键,故B错误;
C.石墨转变为金刚石,有新物质生成,则属于化学变化,故C正确;
D.水很稳定与化学键有关,与分子间作用力无关,故D错误;
故选C.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及物质中的化学键判断为解答的关键,注意结合实例分析,题目难度不大.

练习册系列答案
相关题目
6.前苏联科学家欧巴林教授子啊其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳及水开始的,与之相关的转化如下图所示(部分反应条件已略去)
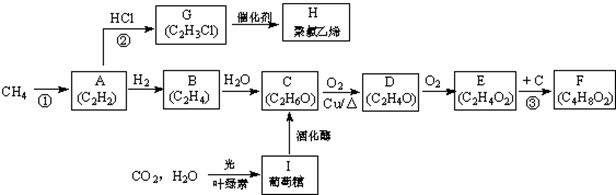
(1)反应②的类型为消去反应,E的官能团的名称羧基
(2)写出结构简式,D为CH3CHO,H为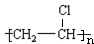
(3)由E生成F的化学方程式为CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,由I生成C的化学方程式为C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2C2H5OH+2CO2
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如下表
反应①2CH4(g)→C2H2(g)+3H2(g)△H=+358kJ•mol-1.

(1)反应②的类型为消去反应,E的官能团的名称羧基
(2)写出结构简式,D为CH3CHO,H为
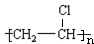
(3)由E生成F的化学方程式为CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,由I生成C的化学方程式为C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2C2H5OH+2CO2
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如下表
| 共价键 | H-H | C-H | C≡C |
| 能量变化/kJ•mol-1 | 436 | 413 | 812 |
7.哈伯因发明了由氮气合成氨气的方法而获得诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生.下列有关说法正确的是( )
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2将完全转化为NH3 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
4.我们使用的塑料食品盒、水杯等通常由聚苯乙烯制成,下列说法正确的是( )
| A. | 聚苯乙烯单体的分子式为C8H8 | |
| B. | 聚苯乙烯属于纯净物 | |
| C. | 聚苯乙烯能与溴水发生加成反应 | |
| D. | 聚苯乙烯是可降解塑料,不会造成白色污染 |
11.下列各组有机物,不论按何种比例混合,只要总质量一定,完全燃烧生成水的总质量就相同的是( )
| A. | 甲烷、丙烷 | B. | 甲苯、甘油 | C. | 甲酸、乙酸 | D. | 乙醇、乙二醇 |
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为10NA |
8.在a mL浓度为c mol•L-1的AgNO3溶液中加入一定体积的pH=l的盐酸时,恰好使溶液中的Ag+完全沉淀,此时得到pH=2的溶液100mL (设反应前后溶液体积变化忽略不计),则c的值是( )
| A. | 0.002 0 | B. | 0.011 | C. | 0.11 | D. | 0.22 |
5.锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
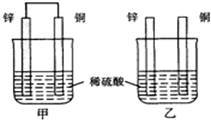

| A. | 两烧杯中溶液的氢离子浓度均减小 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均有气泡产生 | D. | 甲、乙溶液均变蓝色 |
6.用下列实验装置进行相应的实验,能达到实验目的是( )
| A. | 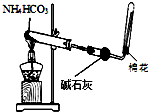 图装置用于制取少量的氨气 | |
| B. | 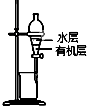 图装置用于提取I2的CCl4溶液中的I2 | |
| C. | 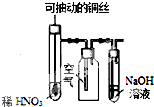 图装置微热稀HNO3,在广口瓶中可收集NO气体 | |
| D. | 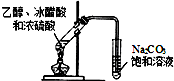 图装置可制取少量的乙酸乙酯 (夹持物略) |