题目内容
16.一定量的金属Cu完全溶于适量浓硝酸中,收集到混合气体(含NO、N2O4、NO2),将上述混合气体平均分为两份,一份与标准状况下4.48L O2混合后,用水吸收生成HNO3且无气体剩余,另一份恰好能被500 mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则其中的NaNO2的物质的量为( )| A. | 0.1mol | B. | 0.15mol | C. | 0.2mol | D. | 0.4mol |
分析 两份中混合气体的含量相同,第一份先与氧气反应,然后与水恰好反应生成硝酸;第二份中与氢氧化钠溶液反应生成亚硝酸钠和硝酸钠,根据电子守恒,若将第二份中的亚硝酸钠氧化成硝酸钠,消耗的氧气一定与第一份中消耗的氧气的量相同,据此结合电子守恒可计算出亚硝酸钠的物质的量.
解答 解:标况下4.48L氧气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,0.2mol氧气反应后得到电子总物质的量为:0.2mol×4=0.8mol,
一份与标准状况下4.48L O2混合后,用水吸收生成HNO3且无气体剩余,若生成的硝酸与氢氧化钠反应恰好生成硝酸钠;
另一份恰好能被500 mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,
由于两份中组成相同,根据电子守恒,若亚硝酸钠转化成硝酸钠,消耗氧气的量也一定为0.2mol,
结合电子守恒可知则亚硝酸钠的物质的量为:$\frac{0.8mol}{5-3}$=0.4mol,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确第二份中亚硝酸钠氧化成硝酸钠消耗的氧气与第一份中消耗的氧气的量相等为解答关键,注意掌握电子守恒在化学计算中的应用方法.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
6.用下列实验装置进行相应的实验,能达到实验目的是( )
| A. | 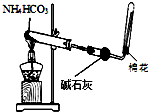 图装置用于制取少量的氨气 | |
| B. | 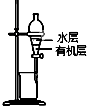 图装置用于提取I2的CCl4溶液中的I2 | |
| C. | 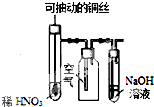 图装置微热稀HNO3,在广口瓶中可收集NO气体 | |
| D. | 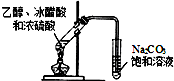 图装置可制取少量的乙酸乙酯 (夹持物略) |
7.下列有关实验操作正确的是( )
| A. | 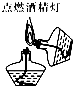 | B. | 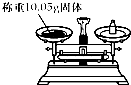 | C. | 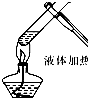 | D. |  |
11.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol.L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1KMnO4溶液:Na+、Mg2+、N03-、S032- |
10.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | 六氯化硫 | B. | BF3 | C. | PCl5 | D. | 光气(COCl2) |
11.下列说法正确的是( )
| A. | 蔗糖、麦芽糖水解都能得到2种物质 | |
| B. | 纤维素、淀粉和蛋白质都是高分子化合物 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 酯类和糖类均能发生水解反应 |