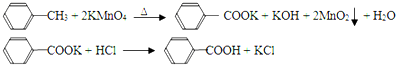
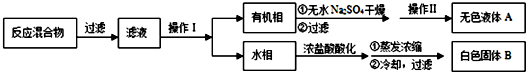
题目内容
4.下列排序不正确的是( )| A. | 最高价氧化物对应水化物的酸性:H2SiO3>H3PO4>H2SO4 | |
| B. | 与冷水的反应速率:K>Na>Mg | |
| C. | 热稳定性:HF>HCl>H2S | |
| D. | 离子半径:Cl->F->Na+ |
分析 A.元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强;
B.元素的金属性越强,对应单质的活泼性越强;
C.元素的非金属性越强,对应的氢化物越稳定;
D.离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小.
解答 解:A.非金属性S>P>Si,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,应为H2SiO3<H3PO4<H2SO4,故A错误;
B.金属性K>Na>Mg,元素的金属性越强,对应单质的活泼性越强,故B正确;
C.非金属性F>Cl>S,元素的非金属性越强,对应的氢化物越稳定,故C正确;
D.Cl-离子核外电子层数最多,离子半径最大,F-、Na+核外电子排布相同,核电荷数越大离子半径越小,则Cl->F->Na+,故D正确.
故选A.
点评 本题考查元素周期率知识,为高频考点,侧重于学生的分析能力和基本概念的考查,注意相关知识的积累,难度不大.

练习册系列答案
相关题目
15.在3L密闭容器中,充入1mol N2和3 mol H2并在一定条件下发生反应,20s后达到反应限度,测得混合气体总物质的量为3.4mol.下列计算结果正确的是( )
| A. | 20s后,混合气中n(H2):n(N2):n(NH3)=1:2:3 | |
| B. | N2的转化率为30% | |
| C. | 20s内H2的平均反应速率为1.5mol•L-1•s-1 | |
| D. | NH3的体积分数为25% |
12.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:下列说法不正确的是( )
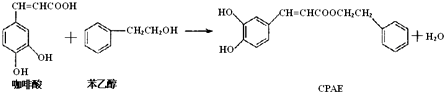

| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
9.X、Y为短周期元素,X位于第ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
16.下列化合物电子式书写正确的是( )
| A. | 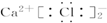 | B. | 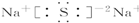 | C. | 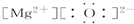 | D. | 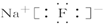 |
13.某有机物的结构简式为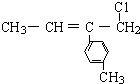 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |
 (1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;
(1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;