题目内容
14. (1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;
(1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+; ⑨-CH3.属于官能团的有(填序号)②⑤⑥.
(2)有下列8种晶体,用序号回答下列问题:
A.水晶 B.冰 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
①属于原子晶体是AG,直接由原子构成的分子晶体是D
②由极性分子构成的分子晶体是B,含有共价键的离子晶体是E
③在一定条件下能导电而不发生化学反应的是F
分子内存在化学键,但受热熔化时,化学键不发生变化的是BC
(3)在NaCl晶胞中8个顶点、6个面心处各有一个Na+,12条棱的中点、体心各有
一个Cl-,KCl和NaCl的晶格形式相同.已知Na+离子的半径是Cl-离子的0.5倍,是K+离子的0.7 倍,计算:KCl晶胞和NaCl晶胞的边长之比为8:7
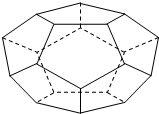
(4)如图:由正五边形构成的多面体有20个顶点,多面体中有12个正五边形,共有30条棱边.
分析 (1)常见的有机物官能团有C=C、C≡C、-X、-CHO、-OH、-COOH、-CO-、-COO-、-NO2等;
(2)①直接由原子构成的且为空间网状结构的晶体为原子晶体;稀有气体是单原子分子构成的分子晶体;
②不同非金属元素之间易形成极性键,由分子构成的晶体是分子晶体;非金属元素之间易形成共价键、活泼金属和活泼非金属元素之间易形成离子键,含有离子键的晶体属于离子晶体;
③金属单质在一定条件下能导电且不发生化学反应;
多原子分子构成的分子晶体熔化时化学键不被破坏;
(3)NaCl晶胞的边长相当于两个钠离子半径、两个氯离子半径,所以其长度为3个氯离子半径;钠离子半径是钾离子半径的0.7倍、是氯离子半径的0.5倍,则钾离子半径是氯离子半径$\frac{5}{7}$,则KCl的边长是氯离子半径的3$\frac{3}{7}$倍;
(4)该多面体中,每个顶点被3个正五边形占有,则平均每个正五边形中含有顶点个数=$\frac{1}{3}×$5,正五边形个数=$\frac{20}{\frac{1}{3}×5}$;每条棱被两个顶点占有,每个顶点占有棱长个数=$\frac{1}{2}$×3,棱个数=20×$\frac{1}{2}×3$.
解答 解:(1)常见的有机物官能团有C=C、C≡C、-X、-CHO、-OH、-COOH、-CO-、-COO-、-NO2等,这些微粒中属于官能团的有②⑤⑥,①③④⑧属于离子,⑦属于分子,⑨为甲基,
故答案为:②⑤⑥;
(2)①直接由原子构成的且为空间网状结构的晶体为原子晶体,属于原子晶体的为AG;稀有气体是单原子分子构成的分子晶体,直接由原子构成的分子晶体为D,
故答案为:AG;D;
②不同非金属元素之间易形成极性键,由分子构成的晶体是分子晶体,由极性分子构成的分子晶体是B;非金属元素之间易形成共价键、活泼金属和活泼非金属元素之间易形成离子键,含有离子键的晶体属于离子晶体,含有共价键的离子晶体是E,
故答案为:B;E;
③金属单质在一定条件下能导电且不发生化学反应,在一定条件下能导电而不发生化学反应的是F;
多原子分子构成的分子晶体熔化时化学键不被破坏,含有化学键的分子晶体为BC;
故答案为:F;BC;
(3)NaCl晶胞的边长相当于两个钠离子半径、两个氯离子半径,所以其长度为3个氯离子半径;钠离子半径是钾离子半径的0.7倍、是氯离子半径的0.5倍,则钾离子半径是氯离子半径$\frac{5}{7}$,则KCl的边长是氯离子半径的3$\frac{3}{7}$倍,所以KCl晶胞和NaCl晶胞的边长之比为3:3$\frac{3}{7}$=8:7,
故答案为:8:7;
(4)该多面体中,每个顶点被3个正五边形占有,则平均每个正五边形中含有顶点个数=$\frac{1}{3}×$5,正五边形个数=$\frac{20}{\frac{1}{3}×5}$=12;每条棱被两个顶点占有,每个顶点占有棱长个数=$\frac{1}{2}$×3,棱个数=20×$\frac{1}{2}×3$=30,
故答案为:12;30.
点评 本题考查晶胞计算、化学键及官能团等知识点,侧重考查学生分析、空间想象能力及计算能力,会利用均摊法计算晶胞是(4)题关键,注意官能团与离子的区别,题目难度不大.


下列有关判断正确的是( )
| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
| A. | CO2和NO2 | B. | B3H6N3和C6H6 | C. | CH4和NH4+ | D. | H2O和CH4 |
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为 |
| A. | 最高价氧化物对应水化物的酸性:H2SiO3>H3PO4>H2SO4 | |
| B. | 与冷水的反应速率:K>Na>Mg | |
| C. | 热稳定性:HF>HCl>H2S | |
| D. | 离子半径:Cl->F->Na+ |
 ),并且乙烯基和次甲基之间必须通过甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为C
),并且乙烯基和次甲基之间必须通过甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为C