题目内容
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
分析 乙烷燃料原电池中,负极发生氧化反应,C2H6+18OH--14e-═2CO32-+12H2O,正极发生还原反应,7H2O+$\frac{7}{2}$O2+14e-=14OH-,根据电极反应式判断电解质溶液的变化以及参加反应物的物质的量之间的关系解答即可.
解答 解:A.燃料乙烷失电子发生氧化反应,是负极,通入氧气的电极为正极,故A错误;
B.原电池中两极上转移的电子相等,当有28mol电子转移时,正极上消耗7molO2,负极上消耗2molC2H6,正极与负极上参加反应的气体的物质的量之比为7:2,故B正确;
C.电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,则KOH的物质的量浓度减小,故C正确;
D.放电时,阴离子移向负极,所以OH-离子向负极移动,故D错误;
故选AD.
点评 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性变化.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
13.酸根离子RO3-所含电子比NO3-多10个,则下列说法中正确的是( )
| A. | RO3-中R元素的化合价与NO3-中的N元素的化合价相同 | |
| B. | R原子的电子层数与N原子电子层数相同 | |
| C. | RO3-中的R元素与NO3-中N元素都只能被还原,不能被氧化 | |
| D. | R元素在自然界中既以游离态又以化合态存在 |
10.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是
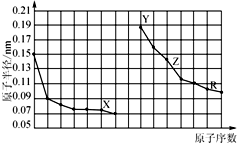

| A. | 同周期元素中,X的气态氢化物最稳定 | |
| B. | Y、Z的单质在空气中加热,均发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z. |
4.下列关于有机化合物的说法正确的是( )
| A. | 煤的液化过程为物理过程 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 酸性高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
14.下列四种元素中,其单质氧化性最强的是( )
| A. | 原子含有未成对电子最多的第二周期元素 | |
| B. | 位于元素周期表中第三周期ⅢA族的元素 | |
| C. | 原子最外层电子排布为2s22p6的元素 | |
| D. | 原子最外层电子排布为2s22p5的元素 |
1.铁的晶体有三种堆积方式,其中两种的堆积方式如下,下列说法正确的是( )


| A. | 空间利用率α-Fe大于γ-Fe | |
| B. | α-Fe、γ-Fe晶胞中铁原子个数比为1:2 | |
| C. | 金属铁的导电性是由于通电时自由电子作定向移动 | |
| D. | α-Fe延展时,可以转变为γ-Fe |
18.下列反应属于放热反应的是( )
| A. | 锌粒与稀H2SO4反应 | B. | NaOH溶于水 | ||
| C. | CaCO3受热分解 | D. | 氯化铵晶体与氢氧化钡晶体反应 |
19.下列涉及有机物的性质的说法正确的是( )
| A. | 苯不能使KMnO4溶液褪色,甲苯使KMnO4溶液褪色,因为甲基活化了苯环 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝变成黑色 | |
| C. | 裂化汽油能萃取溴水中的溴,使溴水褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |