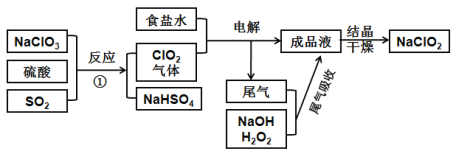
题目内容
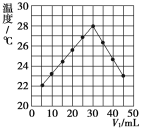
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀关系如图,则下列说法正确的是( )

A. 横坐标为0-50mL时,所有反应为:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓
B. B点生成沉淀的总物质的量0.02mol
C. 若往C点的溶液中加入足量盐酸,沉淀将全部溶解
D. H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:2:2:1
【答案】C
【解析】
根据图象知,横坐标为0-10mL时发生的反应是:H++OH-=H2O,加入10mLNaOH溶液所中和氢离子为:n(H+)=n(NaOH)=0.01L×0.1mol/L=0.001mol;横坐标为50-60mL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×0.1mol/L=0.001mol,再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.001mol;横坐标为10-50mL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据元素-守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),故2n[Mg(OH)2]+0.003=0.04L×0.1mol/L,故n[Mg(OH)2]=0.0005mol,以此解题。
A. 横坐标为0-50mL时,所有反应为:0-10mL时,H++OH-= H2O;10-50mL时,Mg2++2OH-=Mg(OH)2↓ 、Al3++3OH-=Al(OH)3↓,A项错误;
B. B点生成沉淀为Mg(OH)2、Al(OH)3的总物质的量为n[Al(OH)3]+ n[Mg(OH)2]=0.001mol+0.0005mol=0.0015mol,B项错误;
C. 若往C点的溶液中加入足量盐酸,Mg(OH)2+2HCl=MgCl2+2H2O、NaAlO2+4HCl=NaCl+AlCl3+2H2O,将全部溶解,C项正确;
D. 经计算,溶液中H+、Mg2+、Al3+三种阳离子物质的量浓度之比为:0.001mol:0.0005mol:0.001mol,即2:1:2,D项错误;
答案应选C。