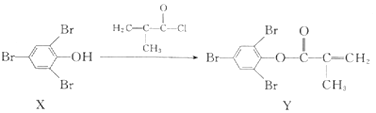
题目内容
【题目】按要求填空:
(1)金刚石、晶体硅、碳化硅,属于____晶体,其熔化时克服的微粒间的作用力是______。
(2)HF、HBr、HI形成的晶体,沸点由高到低的顺序为:_______________。
(3)NH3易液化,解释原因:_______,NH3分子的空间构型为____________。
(4)MgO的熔点比CaO的高,其原因是___________。
【答案】原子 共价键 HF>HI>HBr NH3分子间能形成氢键 三角锥形 二者均为离子晶体,但Mg2+半径小于Ca2+,在离子所带电荷相同的情况下,MgO的晶格能越大,熔点高
【解析】
(1)金刚石、晶体硅、碳化硅都是原子之间通过共价键结合而成的原子晶体,熔点高低由共价键强弱判断;
(2)HF、HBr、HI形成的都是分子晶体,沸点高低由分子间作用力大小判断,HF分子之间存在氢键;
(3)NH3易液化,是由其分子之间存在氢键有关;NH3分子的空间构型为可由杂化轨道理论和价层电子对数判断;
(4)MgO、CaO的熔点高低由离子键决定,离子键强弱通过比较离子键强弱分析。
(1)金刚石、晶体硅、碳化硅都是由原子通过共价键结合而形成的原子晶体,原子晶体的熔沸点高低由共价键的强弱决定。由于共价键强度:C-C>C-Si>Si-Si,共价键越强,断裂吸收的能量越高,物质的熔沸点就越高,所以熔化时克服的微粒间的作用力由大到小的顺序为金刚石>碳化硅>晶体硅。
(2)HF、HBr、HI形成的都是分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔沸点越高。物质的相对分子质量越大,分子间作用力就越强。由于HF分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的作用力,所以HF的沸点最高。相对分子质量HI>HBr,所以物质沸点由高到低的顺序为:HF>HI>HBr;
(3)NH3易液化是由于NH3分子间能形成氢键,增加了分子之间的作用力;NH3分子价层电子对数为3+![]() =4,且N原子上还有1对孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以NH3的空间构型为三角锥形。
=4,且N原子上还有1对孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以NH3的空间构型为三角锥形。
(4)MgO、CaO都是离子晶体,离子间通过离子键结合。由于离子半径Ca2+>Mg2+,离子半径越小,离子键越强,物质的晶格能越大,断裂离子键消耗的能量就越高,物质的熔点沸点就越高,所以MgO的熔点比CaO的高。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案