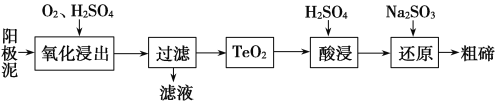
题目内容
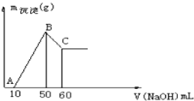
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。请按要求填空:
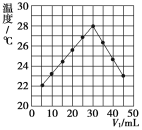
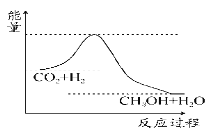
该实验表明此反应__(填“吸收”或“释放”)能量,即:__能可以转化为__能,通过示意图分析可以得出:做该实验时,环境温度__(填“高于”“低于”或“等于”)22℃。
【答案】释放 化学 热 低于
【解析】
从图示观察起始温度即为实验时环境温度,根据中和反应是放热反应分析解答;从起止温度发现发生化学反应温度升高,据此分析能量的转化方式。
从图示观察起始温度即为实验时环境温度,从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,中和反应是放热反应,则溶液混合前的实验环境温度一定低于22℃,反应结束温度为23℃,温度升高,该实验表明此反应释放能量,即化学能转化为热能。

 学而优衔接教材南京大学出版社系列答案
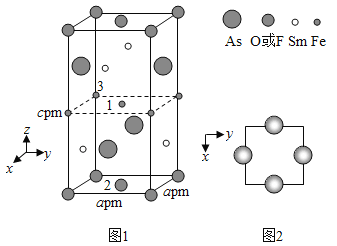
学而优衔接教材南京大学出版社系列答案【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层电子数是D原子最外层电子数的4倍,D的简单离子核外电子排布与C2-相同。

试回答:
(1)元素E在元素周期表中的位置是________。
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是________(用化学式作答,下同)。
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ________Ⅱ________,观察到的实验现象是____。
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子个数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有____________________________________;
②c的电子式为___________________;
③b与c反应的化学方程式为____________________________________。