题目内容
在100 mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如下图所示,有关说法错误的是( )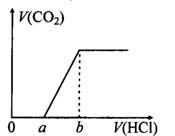
| A.若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+= HCO3- |
| B.若a:b>l:2,且b="20" mL,则原NaOH溶液的浓度为0.02 mol/L |
| C.若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D.a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
C
解析试题分析:A、若a:b<1:2,则溶液X的溶质为Na2CO3和NaHCO3,刚开始滴加盐酸时反应为Na2CO3+HCl=NaHCO3+NaCl,正确;B、b点溶液的溶质为NaCl,由Na元素、Cl元素守恒可知:n(NaOH)="n(NaCl)=n(HCl)=0.002" mol,故原溶液中NaOH浓度为0.02 mol/L,正确;C、若a:b=l:2,则溶液X的溶质为Na2CO3,质子守恒式有:c(H+)+c(HCO3-)=c(OH-)一2c(H2CO3),错误;D、a:b为任意值时溶液X均满足电荷守恒,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),正确;
考点:考查电解质溶液,涉及离子反应及量的关系,离子方程式书写等。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案在某溶液中仅存在NH4+、Fe3+、SO42—三种离子,已知NH4+和SO42—个数比为3︰2,则NH4+、Fe3+、SO42—三种离子的个数比为
| A.6︰1︰9 | B.3︰1︰2 | C.1︰1︰1 | D.9︰1︰6 |
下列说法正确的是
| A.相同物质的量的O2和O3,体积相同 |
| B.离子化合物一定含有离子键,可能含有共价键 |
| C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快 |
三草酸合铁酸钾晶体[K3Fe(C2O4)3?xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820 g三草酸合铁酸钾晶体,配制成250 mL溶液。(2)取所配溶液25.00 mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0. 1000 mol/L KMnO4溶液24.00 mL。[K3Fe(C2O4)3的相对分子质量为437] 下列说法正确的是
| A.步骤(2)中KMnO4表现还原性 |
| B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 |
| C.样品中结晶水的物质的量为0.03 mol |
| D.该晶体的化学式为K3Fe(C2O4)3?3H2O |
设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
| A.20mL 10 mol/L浓硫酸或浓硝酸与足量铜加热反应转移电子数均为0.2NA |
| B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C.标准状况下,2.24LCl2通人足量H2O或NaOH溶液中转移的电子数均为0.1NA |
| D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
NA为阿伏加德罗常数,下列叙述正确的是
| A.10 g H18 2O含有的中子数为5NA |
| B.1 mol羟基(-OH)含有的电子数为10NA |
| C.1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D.标准状况下,11.2L己烷含有的分子数为0.5NA |
下列说法不正确的是(设NA表示阿伏加德罗常数的值)
| A.可用盐析法分离NaCl溶液和淀粉胶体 |
| B.天然油脂的分子中含有酯基,属于酯类 |
| C.T℃时,1 L pH=6的纯水中,含有的OH-数目为l×10-6NA |
| D.12.0 gNaHSO4固体中含有的阳离子数目为0.1 NA |