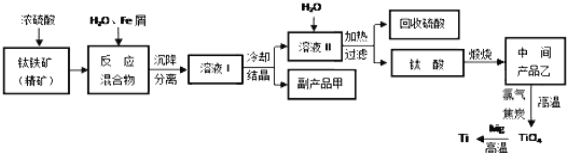
题目内容
【题目】已知:KSP(BaSO4)=2×10-10,KSP(BaSO3)=2.5×10-7,现有一Na2SO4、Na2SO3的混合溶液,其中c(Na2SO3)=0.5mol/L,c(Na2SO4)=0.05mol/L。若向该溶液中加入等体积的0.5mol/LBaCl2溶液,充分反应后,溶液中c(Ba2+)=__(混合时溶液体积变化忽略不计)。若向该混合溶液中加BaCl2固体,当SO32-开始沉淀时,c(SO42-)=___;当SO42-沉淀完全时,c(SO32-)=___。
【答案】1×10-5mol/L 4×10-4mol/L 1.25×10-2mol/L
【解析】
当溶液中的离子开始生成沉淀时,该物质在溶液中已达沉淀溶解平衡,可利用KSP进行计算;当离子在溶液中沉淀完全时,其离子浓度为1×10-5mol/L。
若向该溶液中加入等体积(设为1L)的0.5mol/LBaCl2溶液,充分反应后,
Ba2+ + SO42-=BaSO4↓
0.05mol 0.05mol
Ba2+ + SO32-=BaSO3↓
0.45mol 0.45mol
所以溶液中剩余SO32-的物质的量为0.05ml,c(SO32-)=![]() ,
,
c(Ba2+)=![]() mol/L,
mol/L,
答案为:1×10-5mol/L;
若向该混合溶液中加BaCl2固体,当SO32-开始沉淀时,SO32-在溶液中达沉淀溶解平衡,
c(Ba2+)=![]() mol/L,
mol/L,
则c(SO42-)=![]() mol/L,
mol/L,
答案为:4×10-4mol/L;
当SO42-沉淀完全时,c(SO42-)=1×10-5mol/L,
此时c(Ba2+)=![]() mol/L,
mol/L,
则c(SO32-)=![]() mol/L,
mol/L,
答案为:1.25×10-2mol/L。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目