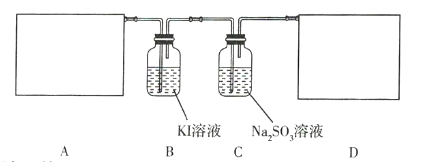
题目内容
【题目】金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
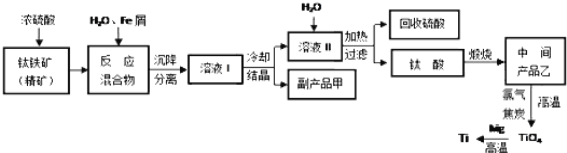
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
【答案】2Fe3++Fe=3Fe2+,将Fe3+还原为Fe2+; 取样放于试管,滴加KSCN溶液,若有血红色出现则变质,若无血红色则未变质 蒸发浓缩,冷却结晶,过滤洗涤 玻璃棒,引流作用 TiO2+2C+2Cl2![]() TiCl4+2CO 优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高 208.5g
TiCl4+2CO 优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高 208.5g
【解析】
(1) 亚铁离子易被氧化为铁离子,加入铁屑可防止Fe2+被氧化,检验副产品甲是否变质,只要检验其中是否有铁离子即可;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体;
(3) TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
(4)根据FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,计算晶体质量。
(1)钛铁矿和浓硫酸反应的产物是TiOSO4、FeSO4,加入铁屑可防止Fe2+被氧化,2Fe3++Fe=3Fe2+;亚铁离子易被氧化为铁离子,检验副产品甲是否变质,只要检验其中是否有铁离子即可,实验方法是:取副产品甲少许于试管中,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器为玻璃棒,玻璃棒在此操作中的主要作用是引流作用;
(3) TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成,反应的化学方程式为:TiO2+ 2C +2Cl2![]() TiCl4+2CO;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,反应的方程式为TiO2
TiCl4+2CO;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,反应的方程式为TiO2 ![]() Ti+O2↑,经对比,电解法的优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
Ti+O2↑,经对比,电解法的优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
(4)该工艺中消耗![]() 标况
标况![]() ,Cl2物质的量=
,Cl2物质的量=![]() mol=1.5mol,依据反应FeTiO3+2H2SO4 = TiOSO4+FeSO4+2H2O,TiO2+ 2C +2Cl2
mol=1.5mol,依据反应FeTiO3+2H2SO4 = TiOSO4+FeSO4+2H2O,TiO2+ 2C +2Cl2![]() TiCl4+2CO得到FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,消耗
TiCl4+2CO得到FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,消耗![]() Cl2,获得0.75molFeSO47H2O,则晶体质量=0.75mol ×278g/mol=208.5g。
Cl2,获得0.75molFeSO47H2O,则晶体质量=0.75mol ×278g/mol=208.5g。

【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀