题目内容
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
3A(g)+2B(g)
 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )A.该反应的化学平衡常数表达式是K=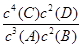 |
| B.此时B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
B
试题分析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知A不正确,因为生成物C是固体;生成1.6molC的同时必然消耗0.8molB,所以B的转化率是40%,B正确;平衡常数只与温度有关系,改变压强平衡常数不变,C不正确;同样D也是错误的,平衡常数不变,答案选B。
点评:该题是基础性试题的考查,难度不大。该题学生容易错选A选项,主要是由于对概念的不清楚或者是审题不明确导致的。本题有利于培养学生的规范答题、审题能力。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
 B(g); △H < O在测定A的相对分子质量时,下列条件中测定结果误差最小的是( )
B(g); △H < O在测定A的相对分子质量时,下列条件中测定结果误差最小的是( ) ?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
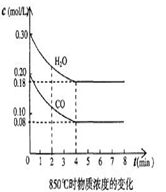
 CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是( )
CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是( ) H2(g) +I2(g). 在
H2(g) +I2(g). 在 CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为
CO2(g)+H2(g), 若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为 H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表: