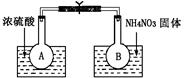
题目内容
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) 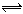 H2(g) +I2(g). 在
H2(g) +I2(g). 在
反应趋向平衡状态过程中,下列说法正确的是 ( )
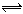 H2(g) +I2(g). 在
H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
| A.HI的分解速率小于其生成速率 | B.HI的分解速率等于其生成速率 |
| C.HI的分解速率大于其生成速率 | D.无法判断 |
C
试题分析:起始时,HI分解速率大,生成速率为0,随着反应进行,HI分解速率减小、生成速率增大。建立平衡前,HI分解速率大于HI生成速率,达到平衡时,HI分解速率和生成速率相等。
点评:起始时反应物浓度最大,正反应速率最大,逆反应速率为0;随着反应进行,反应物浓度减小、生成物浓度增大,所以正反应速率减小、逆反应速率增大,当正、逆反应速率相等时即达到平衡状态。

练习册系列答案
相关题目
 xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是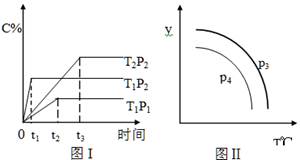


 nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )
nC(g)符合下列图1所示关系。由此推断,对图Ⅱ的说法不正确的是( )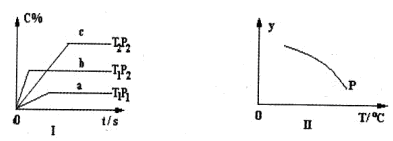
 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )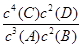
 2AB2(g) 达到平衡状态的标志是 ( )
2AB2(g) 达到平衡状态的标志是 ( ) CO(g)+H2O(g),
CO(g)+H2O(g), 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的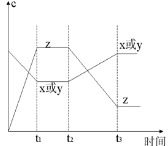
 N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: