题目内容
(10分) 在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)?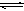 ?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度、体积不变,若起始时向容器中加入的物质的量如下列各项,反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
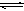 ?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度、体积不变,若起始时向容器中加入的物质的量如下列各项,反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
| A.2 mol X、1 mol Y、1 mol Ar | B.a mol Z、1 mol W |
| C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W | D.2 mol X、1 mol Y、1 mol Z |
(1)减少 (2)a=1 (3)正确 反应物没有完全转化,所以放出的热量少
(4)ABC (每空2分)
(4)ABC (每空2分)
试题分析:(1)ΔH<0,说明是个放热反应,故升高温度,反应向左进行,故平衡常数减小,平衡常数为生成物的化学计量数次幂比上反应物的化学计量数次幂。
(2)升高温度,反应向左进行,混合气体的平均相对分子质量减小,说明生成物的化学计量数之和小于反应物的化学计量数之和,故a+1<3,a<2,故a为1。
(3)反应物没有完全转化,所以放出的热量少,故Q1一定小于Q。
(4)利用“一边倒”的方法计算X和Y的物质的量和开始加入的2 mol X和1 mol Y相比,若一样,则相等,此外,还要考虑,对于体积固定的密闭容器,加入惰性气体是没有影响反应方向。
点评:此题考核了对化学平衡常数的理解和掌握。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
 pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是:
pC(g);△H<0。在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是: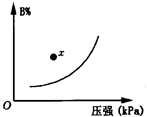
 2(t-BuNO) 。
2(t-BuNO) 。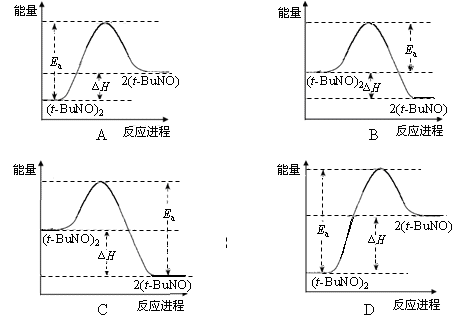


 CO(g)+H2 (g)
CO(g)+H2 (g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )