题目内容
( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
t1℃时物质浓度(mol/L)的变化
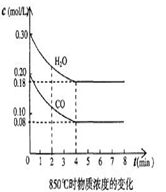
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量 (填增大、减小或不变)。
②表中3 min~4 min之间反应处于 状态;CO的体积分数 16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为 。
 H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表: | 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
t1℃时物质浓度(mol/L)的变化

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量 (填增大、减小或不变)。
②表中3 min~4 min之间反应处于 状态;CO的体积分数 16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为 。
1)放热(2)①不变 ②化学平衡 大于 ③D A(3)75%
试题分析:(1)题随着温度的升高,平衡常数在降低,说明该反应的正反应是放热反应。
(2)①密闭容器中混合气体的平均摩尔质量=混合气体的总质量÷总的物质的量,由于是在密闭容器中,2min时和3min时混合气体的总质量不变,而且该反应是一个等体积反应及以2min时和3min时混合气体的总的物质的量也不变,所以与2min时相比,3min时密闭容器中混合气体的平均摩尔质量不变。②表中3 min和4 min时反应物和生成物的浓度均没有发生变化,所以3 min~4 min之间反应处于化学平衡状态,CO的体积分数的体积分数大于16%。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是升高了温度,增加了生成物的浓度,故选D,表中5 min~6 min之间,生成物的浓度在增加,平衡向正反应方向移动,同时水蒸气的浓度也在增加,故可能的原因是增加了水蒸气的量,选A.
(3)题反应在500℃时进行时平衡常数是9,设达到平衡时H2的物质的量为X,此时可解得X=0.005,所以CO的转化率为75%
点评:本题重在考查化学平衡的移动,考查的知识点都是平常所见的,属于中等难度的题,学生需要对图像进行分析,注意图像中的横纵坐标,以及曲线的变化趋势,以及特殊点。本题涉及的平衡的计算难度不高

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )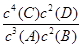
 CO(g)+H2O(g),
CO(g)+H2O(g),

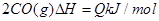 。右图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是( )
。右图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是( )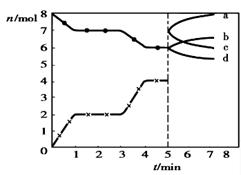
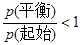
 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的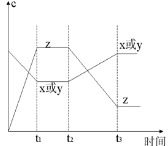
 3C(g)达到平衡的标志是:
3C(g)达到平衡的标志是: 3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )