题目内容
14.在短周期主族元素中:(1)由两种元素组成的化合物种类最多,其中最简单化合物的电子式为
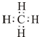 .
.(2)元素D的氢化物与D的最高价氧化物对应水化物化合得到的物质是(填化学式)NH4NO3;D的氢化物的水溶液常温下pH>7(填“>”、“<”、“=”);D的最高价氧化物对应水化物的浓溶液与试管中足量铜片反应,开始产生有色气体,一段时间后则产生无色气体,写出产生无色气体的离子方程式8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O.
(3)元素R与元素E的原子序数之比为2:1,其单质直接反应后得到的化合物中元素质量比为1:1,该化合物的化学式为SO2;该化合物能(填“能”或“不能”)使品红溶液褪色.若含2molR元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定:小于22.4L(填“大于”,“小于”或“等于”).
分析 在短周期主族元素中:
(1)元素组成的化合物种类最多为碳元素和氢元素,它们形成的最简单化合物为CH4;
(2)元素D的氢化物与D的最高价氧化物对应水化物能化合,则D为N元素,D的氢化物为氨气,D的最高价氧化物对应水化物为硝酸,据此答题;
(3)元素R与元素E的原子序数之比为2:1,其单质直接反应后得到的化合物中元素质量比为1:1,则R为S元素,E为O元素,浓硫酸与足量的铜反应,浓度降低后反应会停止,硫酸不能完全反应,据此答题.
解答 解:(1)元素组成的化合物种类最多为碳元素和氢元素,它们形成的最简单化合物为CH4,其电子式为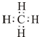 ,
,
故答案为: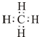 ;
;
(2)元素D的氢化物与D的最高价氧化物对应水化物能化合,则D为N元素,D的氢化物为氨气,D的最高价氧化物对应水化物为硝酸,氨气和硝酸化合得到的物质是NH4NO3,氨水溶液常温下pH>7,铜与浓硝酸反应开始生成二氧化氮,反应一段时间后硝酸浓度下降,会生成一氧化氮,生成一氧化氮的反应的离子方程式为8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O,
故答案为:NH4NO3;>;8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O;
(3)元素R与元素E的原子序数之比为2:1,其单质直接反应后得到的化合物中元素质量比为1:1,则R为S元素,E为O元素,该化合物为SO2,能使品红褪色,浓硫酸与足量的铜反应,浓度降低后反应会停止,硫酸不能完全反应,所以含2mol硫酸的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定小于22.4L,
故答案为:SO2;能;小于.
点评 本题考查元素及其化合物的性质,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意把握常见元素及化合物的性质.

练习册系列答案
相关题目
9.下列各组物质不能实现直接转化的是( )
| A. | SO2→H2SO4 | B. | Cu→CuCl2 | C. | Al2O3→Al(OH)3 | D. | Na→Na2O |
4.下列事实可以表明醋酸是弱电解质的是( )
| A. | 醋酸能与水任意比例互溶 | |
| B. | 醋酸溶液的导电能力比盐酸弱 | |
| C. | 醋酸溶液中存在醋酸根离子、氢离子 | |
| D. | 常温下,1 mol•L-1的醋酸中c(H+)约为0.01 mol•L-1 |

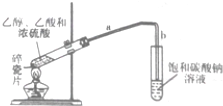 合成乙酸乙酯的路线如下:
合成乙酸乙酯的路线如下: .
.