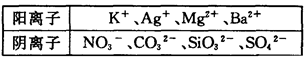题目内容
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
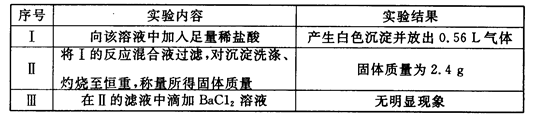
①若向原溶液中加入KSCN溶液,无明显现象;
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变;
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题:
(1)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象是________________;实验中中所发生反应的离子方程式是_________________________;
(2)原溶液中所含阳离子是(写离子符号)___________________.
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是________________g。
(1)溶液呈血红色 3Fe2++NO3-+4H+ = 3Fe3+ +NO↑+2H2O Fe3++3SCN-=Fe(SCN)3
(2)Fe2+、 Cu2+ (3)16
解析试题分析:根据“①若向溶液中加入KSCN溶液,无明显变化”,说明原溶液中不含Fe3+;根据“②若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变”,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+;根据“③若向溶液中加入BaCl2溶液,有白色沉淀生成”,说明原溶液中含有SO42-。各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+;阴离子是NO3-、Cl-、SO42-;(1)向原溶液中先加入少量盐酸,发生反应3Fe2++NO3-+4H+ = 3Fe3+ +NO↑+2H2O,生成Fe3+,再滴入KSCN溶液,发生反应Fe3++3SCN-=Fe(SCN)3,实验现象为溶液呈血红色;(2)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为0.1mol可知m(CuO)=0.1mol×80g/mol=8g,m(Fe2O3)=0.5×0.1mol×160g/mol=8g,所得固体的质量为16g。
考点:考查离子的检验、鉴别以及有关计算

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| H2O(液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为 ,在液氨中形成复分解反应的化学方程式为 。