题目内容
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子: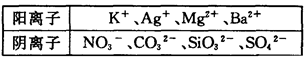
取该溶液100mL进行如下实验(气体体积在标准状况下测定):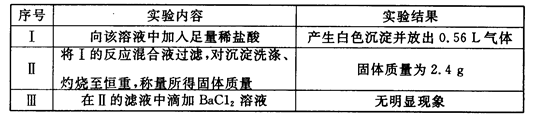
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是____________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)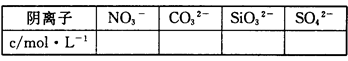
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_____________。
(1)Ag+、Mg2+、 Ba2+ (2)c(NO3-)=?c(CO32-)="0.25mol/L" c(SiO32-)="0.4mol/L" c(SO42-)=0mol/L
(3)存在,其最小浓度为0.8mol/L
解析试题分析:(1)加入盐酸产生气体,说明含有CO32-。n(CO32-)="0.56÷22.4=0.025mol" c(CO32-)="0.25mol/L" n(Na)=0.1L×0.5mol/L=0.05mol=2n(CO32-).∵CO32-和Ag+、Ba2+、 Mg2+会发生沉淀反应而不能大量共存,加入盐酸产生沉淀应该是SiO32-与氢离子发生沉淀反应:2H++SiO32-=H2SiO3↓。结合电荷守恒可知不含有Ag+、Mg2+、 Ba2+。(2)H2SiO3 H2O+SiO2.n(SiO2)="2.4g÷60g/mol=0.04mol." n((SiO32-)= n(SiO2)= 0.04mol.;c(SiO32-)=0.4mol/L.向溶液中加入BaCl2无沉淀说明不含硫酸根离子。c(SO42-)=0mol/L根据实验不能确定NO3-是否存在。(3)根据溶液电中性原理溶液一定含有K+离子。若不存在NO3-。则n(K+)="2" n((SiO32-)="0.08mol,C(K+)=0.8" mol/L.若存在NO3-则C(K+)>0.8 mol/L。
H2O+SiO2.n(SiO2)="2.4g÷60g/mol=0.04mol." n((SiO32-)= n(SiO2)= 0.04mol.;c(SiO32-)=0.4mol/L.向溶液中加入BaCl2无沉淀说明不含硫酸根离子。c(SO42-)=0mol/L根据实验不能确定NO3-是否存在。(3)根据溶液电中性原理溶液一定含有K+离子。若不存在NO3-。则n(K+)="2" n((SiO32-)="0.08mol,C(K+)=0.8" mol/L.若存在NO3-则C(K+)>0.8 mol/L。
考点:考查离子共存及鉴定的知识。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出离子方程式:
实验①:______________________________________________________;
实验②:______________________________________________________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
| A.Br2>I2 | B.Fe3+>Br2 | C.Br2>Fe3+ | D.I->Br- |
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显现象;
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变;
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题:
(1)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象是________________;实验中中所发生反应的离子方程式是_________________________;
(2)原溶液中所含阳离子是(写离子符号)___________________.
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是________________g。
 Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O 、SO
、SO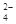 、NH
、NH 、CO
、CO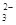 (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验: