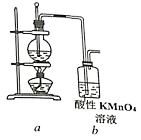
题目内容
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
【答案】B
【解析】
A、催化剂能降低反应的活化能,从而改变反应速率,但不能改变反应物和生成物的能量,因此不能改变反应的反应热,故A错误;
B、CO(g)的燃烧热是283.0kJ/mol,CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故B正确;
O2(g)=CO2(g)△H=-283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故B正确;
C、反应是吸热还是放热,与反应条件无关,可燃物的燃烧也需要加热,但属于放热反应,故C错误;
D、一水合氨属于弱电解质,氨水的电离是吸热过程,因此H2SO4和NH3.H2O反应的中和热ΔH>-57.3kJ/mol,故D错误;
故选B。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
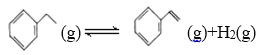
一段时间后,反应达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B.反应在前20 min内的平均反应速率v(H2)=0.008 mol·L-1·min-1
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,体系的总压增大,平衡时苯乙烷的分压也增加。
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,则达到平衡前:v正<v逆