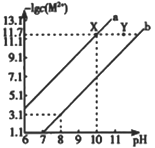
题目内容
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
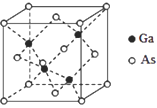
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
【答案】第四周期第Ⅷ族 3s23p4 As>Se>Ga sp3 三角锥形 均为原子晶体,且GaN中N原子半径小,Ga-N 键长比Ga-As短,键能更大,熔点更高 CCl4、SiCl4、 SiF4、 CF4(填其中一种即可) 正四面体形 ![]() ×1010
×1010
【解析】
(1)镍是28号元素,根据构造原理,可确定Ni、S的核外电子排布式,结合原子结构与元素在元素周期表的位置关系确定其在周期表中的位置;一般情况下,同一周期的元素原子序数越大,元素的第一电离能就越大,但当原子核外电子处于其轨道上的全满、半满、全空时是稳定结构,比相应原子序数大1个的VIA的元素大分析。
(2)根据As原子最外层电子数及形成化学键的关系分析Na3As3中As原子的杂化方式;AsCl3的空间构型要根据成键电子对与孤对电子分析其空间构型;
(3)GaAs根据微粒间的作用力与微粒半径大小分析物质熔点高低;
(4)根据等电子体的概念分析其相应的等电子体;
(5)根据微粒的空间构型及相对位置分析其空间构型,用均摊法先计算晶胞中含有的As、Ga原子数目,计算出晶胞的质量,结合晶胞的密度可得晶胞的体积。
(1)镍是28号元素,根据构造原理,可确定Ni核外电子排布式是1s22s22p63s23p63d84s2,在元素在元素周期表的位置为第四周期第Ⅷ族;S原子的价电子排布式为1s22s22p4;一般情况下,同一周期的元素原子序数越大,元素的第一电离能就越大,但As原子核外最外层的4p轨道的电子处于半充满的较稳定状态,比同周期原子序数大1个的VIA的Se元素大,所以Ga、As和Se的第一电离能由大到小的顺序是As>Se>Ga。
(2)在Na3As3中As最外层有5个电子,形成3个共价键即δ键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;AsCl3中As的价层电子对数=3+![]() (5-1×3)=4,As原子采用sp3杂化,由于孤电子对对成键电子对排斥了强,所以AsCl3分子空间构成三角锥形分子;
(5-1×3)=4,As原子采用sp3杂化,由于孤电子对对成键电子对排斥了强,所以AsCl3分子空间构成三角锥形分子;
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN是因为两种晶体均为原子晶体,且GaN中N原子半径比Ga小,Ga-N 键长比Ga-As短,键能更大,断裂化学键需要的能量大,因此熔点更高;
(4)根据等电子体的概念是原子数相同,最外层电子数也相同的微粒,则SO42-相应的等电子体是CCl4、SiCl4、 SiF4、 CF4;
(5)该晶胞中Ga原子处于与它最近的四个As原子所构成的正四面体的几何中心,因此Ga所处空隙类型为正四面体;在该晶胞中含有的As原子数目为:![]() =4,含有的Ga原子数目为:1×4=4,因此该晶胞在含有4个GaAs,则晶胞的质量为m=
=4,含有的Ga原子数目为:1×4=4,因此该晶胞在含有4个GaAs,则晶胞的质量为m=![]() g,由于晶胞的密度为ρg/cm3,所以晶胞的体积为V=
g,由于晶胞的密度为ρg/cm3,所以晶胞的体积为V=![]() cm3,则晶胞的边长L=
cm3,则晶胞的边长L=![]() cm=
cm=![]() ×1010pm。在该晶体在两个Ga原子之间的距离为晶胞边长的
×1010pm。在该晶体在两个Ga原子之间的距离为晶胞边长的![]() 倍,所以两个Ga原子之间的距离为
倍,所以两个Ga原子之间的距离为![]() ×1010pm。
×1010pm。

【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |