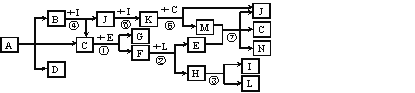
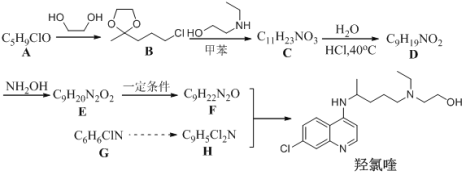
题目内容
【题目】硼是一种奇特的元素,它来自超新星爆发和宇宙射线的散列辐射。
(1)写出BF3电子式___________,B与F形成共价键时,共用电子对偏向_____原子,判断依据是_________________。
(2)硼酸(H3BO3)在水中电离出阴离子[B(OH)4]-,请写出硼酸的电离方程式___________。
【答案】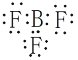 氟 B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B B(OH)3+H2O
氟 B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B B(OH)3+H2O![]() [B(OH)4]-+ H+
[B(OH)4]-+ H+
【解析】
(1)BF3中每个氟原子与硼原子形成一对共用电子对;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,据此分析解答;
(2)硼酸(H3BO3)能电离,它在水中能结合水电离出的OH-,形成[B(OH)4]-离子,结合水的电离可知硼酸还应该电离出氢离子,据此写出硼酸的电离方程式。
(1)BF3中每个氟原子与硼原子形成一对共用电子对,则电子式为 ;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B,则共用电子对偏向于氟原子;
;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B,则共用电子对偏向于氟原子;
(2)硼酸(H3BO3)能电离,它在水中能结合水电离出的OH,形成[B(OH)4]-离子,则硼酸还电离出氢离子,则其电离方程式为:B(OH)3+H2O![]() [B(OH)4]-+ H+。
[B(OH)4]-+ H+。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
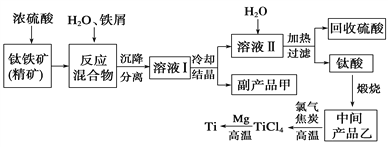
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。