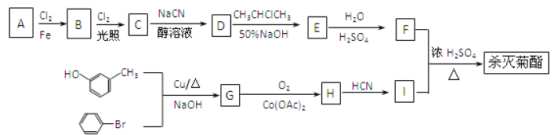
题目内容
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
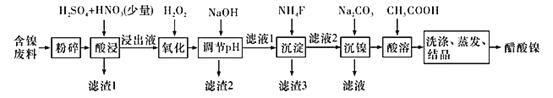
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
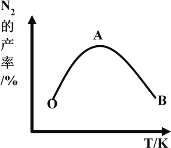
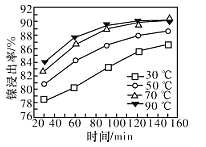
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。
【答案】加快化学反应速率,提高镍的浸出率 NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O 2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O 5.0 ≤pH < 6.7 CaF2 31.4g 70 120
【解析】
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0 ≤pH < 6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)粉碎含镍废料的作用是加快化学反应速率,提高镍的浸出率;故答案为:加快化学反应速率,提高镍的浸出率。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体,则为NO和SO2,其反应的化学方程式为:NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O;故答案为:NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O。
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;故答案为:2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。
(4)调节pH除铁、铝步骤中,要将Fe3+、Al3+除尽,但不能除掉Ni2+,因此溶液pH的调节范围是5.0 ≤pH < 6.7;故答案为:5.0 ≤pH < 6.7。
(5)由流程以及物质的溶解性分析可知,滤渣3主要成分的化学式是CaF2;故答案为:CaF2。
(6)沉镍过程中,已知NiCO3的Ksp=9.60×10-6,先Na2CO3沉淀Ni2+生成NiCO3,100mL溶液中c(Ni2+ )=2.0 mol·L-1,n(Ni2+ )= 2.0 mol·L-1×0.1L =0.2mol,消耗n(Na2CO3)=0.2mol,则Na2CO3溶液中再将Ni2+沉淀完全,即c(Ni2+)≤10-5 mol·L-1,![]() ,消耗n(Na2CO3)= 0.96 mol·L-1×0.1L =0.096 mol,共消耗n(Na2CO3)= 0.2mol + 0.096 mol=0.296mol,即质量m(Na2CO3) = 0.296mol×106gmol-1 = 31.4g;故答案为:31.4g。
,消耗n(Na2CO3)= 0.96 mol·L-1×0.1L =0.096 mol,共消耗n(Na2CO3)= 0.2mol + 0.096 mol=0.296mol,即质量m(Na2CO3) = 0.296mol×106gmol-1 = 31.4g;故答案为:31.4g。
(7)根据图像分析可知,70℃和90℃在120min时差不多,而再延长时间,镍浸出率增加不大,因此酸浸的最佳温度与时间分别为70℃、120min。

 导学教程高中新课标系列答案
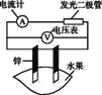
导学教程高中新课标系列答案【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑桔 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
请回答以下问题:
(1)实验6中负极的电极反应式为____。
(2)实验1、5中电流方向相反的原因是____。
(3)影响水果电池电压的因素有_____、____。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做____。(填“合理”或“不合理”)
【题目】如图量一套检验气体性质的实验装置。向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是 ( )

A | B | C | D | |
X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHCO3 |
A.AB.BC.CD.D