题目内容
【题目】已知在800K时,反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
【答案】75%
【解析】
根据CO的平衡转化率可计算出平衡时各种物质的平衡浓度,代入平衡常数表达式得到该温度下的化学平衡常数,然后利用平衡常数只与温度有关,将H2O的起始浓度本变为6mol/L,利用物质反应转化关系,结合平衡常数的值可计算出CO转化量,进而可得其平衡转化率。
反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%,则CO转化的物质的量浓度△c(CO)=2mol/L×60%=1.2mol/L,则第一次平衡时各物质的浓度:c(CO)=0.8mol/L,c(H2O)=3mol/L-1.2mol/L=1.8mol/L,c(CO2)=c(H2)=1.2mol/L,该温度下的化学平衡常数K=
CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%,则CO转化的物质的量浓度△c(CO)=2mol/L×60%=1.2mol/L,则第一次平衡时各物质的浓度:c(CO)=0.8mol/L,c(H2O)=3mol/L-1.2mol/L=1.8mol/L,c(CO2)=c(H2)=1.2mol/L,该温度下的化学平衡常数K=![]() =1.0。设第二次平衡时,CO的转化浓度为x,则反应的H2O的浓度为x,反应产生的CO2、H2的浓度也为x,平衡时c(CO)=(2-x),c(H2O)=6-x,由于化学平衡常数K=1.0,
=1.0。设第二次平衡时,CO的转化浓度为x,则反应的H2O的浓度为x,反应产生的CO2、H2的浓度也为x,平衡时c(CO)=(2-x),c(H2O)=6-x,由于化学平衡常数K=1.0,![]() =1.0,解得x=1.5mol/L,所以CO的平衡转化率为
=1.0,解得x=1.5mol/L,所以CO的平衡转化率为![]() ×100%=75%。
×100%=75%。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

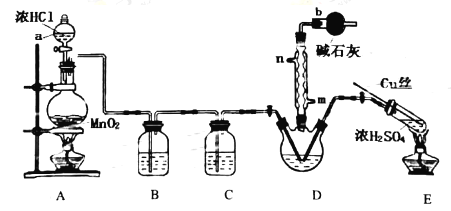
①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
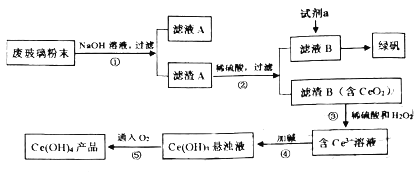
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
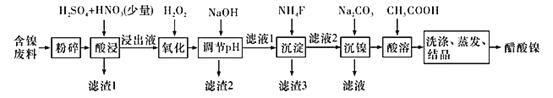
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
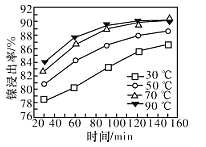
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。