题目内容
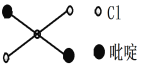
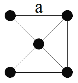
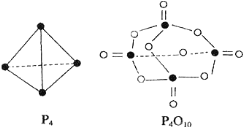
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
【答案】B
【解析】
化学反应的实质是反应物原有化学键的断裂和生成物新化学键生成的过程。依据键能的数值可以估算化学反应的热效应,即△H=反应物的键能总和-生成物的键能总和。根据反应P4+5O2═P4O10,并结合物质的结构式可知,白磷分子中含有6个P-P键,氧气中含有1个O=O键,P4O10分子中含有4个P=O键和12个P-O键,因此该反应的△H=6a+5d-(4c+12b),由于该反应为放热反应,△H为负值,则1mol白磷反应放出的热量为(4c+12b-6a-5d)kJ。
故选B。

练习册系列答案
相关题目