题目内容
【题目】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则H2=_________。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______(填序号)。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________,该温度下反应的平衡常数K=_______________。(答案可用分数表示)
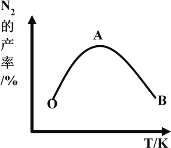
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________。
(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________(填序号)。
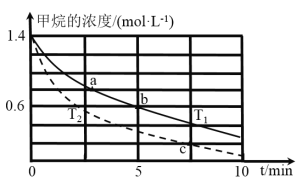
A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______。
【答案】-1160kJ/mol C 0.04mol/(L·min) ![]() OA段随着温度的升高,催化剂的活性增强,化学反应速率加快,因此氮气的产率逐渐增大 C CH4-8e-+10OH-=CO32-+7H2O
OA段随着温度的升高,催化剂的活性增强,化学反应速率加快,因此氮气的产率逐渐增大 C CH4-8e-+10OH-=CO32-+7H2O
【解析】
(1)根据盖斯定律计算。
(2)根据勒夏特列原理判断。
(3)根据三段式法计算。
(4)氮气的产率与速率有关,而速率与催化剂、温度相关。
(5)根据图象判断。
(6)根据碱性环境,可以知道CO2最终转化为CO32-。
(1)在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则③2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)H3=-1734kJ/mol,根据盖斯定律,②=③-①,所以H2=H3-H1=-1160kJ/mol。
(2)反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O为放热、体积不变的可逆反应,欲使N2的平衡产率提高,可使平衡正向进行,则反应条件是降低温度,答案为C。
(3)根据三段式法:
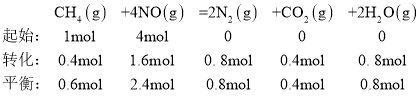
由于反应前后体积不变,因此,反应开始到达平衡用NO来表示的反应速率v(NO)=![]() =0.04mol/(Lmin)。根据平衡常数的定义
=0.04mol/(Lmin)。根据平衡常数的定义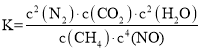 ,代入数据,得到K=
,代入数据,得到K=![]() 。
。
(4)氮气的产率与速率有关,而速率与催化剂、温度相关。当温度升高时,催化剂的活性増强,化学反应速率加快,因此氮气的产率逐渐增大。
(5)A.根据图象,相同时间内,T2比T1反应进行的程度大,因此T2>T1,A说法错误;
B.c点甲烷转换的浓度为1.2mol/L,因此二氧化碳的浓度也是1.2mol/L,B说法错误;
C.在同一温度未达平衡前,a点反应物浓度大于b点反应物浓度,a点的正反应速率大于b点的正反应速率;未达平衡时,b点的正反应速率大于b点的逆反应速率,所以a点的正反应速率大于b点的逆反应速率,C说法正确;
D.a点所处的温度低于c点所处的温度,但a点的反应物的浓度大于c点的反应物浓度,因此两点的速率无法比较,说法错误;
答案为C。
(6)根据碱性环境,可以知道CO2最终转化为CO32-,根据得失电子守恒和物料守恒,可以得出负极电极反应式为CH4-8e-+10OH-=CO32-+7H2O。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
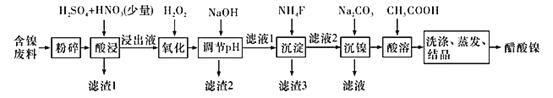
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
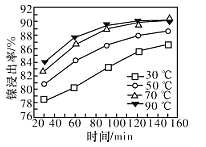
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。