��Ŀ����
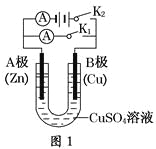
����Ŀ��ijͬѧ����ͼ��ʾ��ˮ����ص�ʵ��,����������±���ʾ��
������ | �缫���� | ˮ��Ʒ�� | �缫���/cm | ��ѹ/mV | |
1 | п | ͭ | ���� | 3 | 900 |
2 | п | ͭ | ƻ�� | 3 | 650 |
3 | п | ͭ | �̽� | 3 | 850 |
4 | п | ͭ | ������ | 3 | 750 |
5 | п | �� | ���� | 3 | 650 |
6 | п | �� | ƻ�� | 3 | 450 |
��ش��������⣺
��1��ʵ��6�и����ĵ缫��ӦʽΪ____��
��2��ʵ��1��5�е��������෴��ԭ����____��
��3��Ӱ��ˮ����ص�ѹ��������_____��____��
��4������ʵ���з�������ܲ�������ͬѧ��ͭ��п���缫���ò��������ʣ���������˵�ش����������ٽӷ�������ܣ�������____��(����������������������)
���𰸡�Al-3e-=Al3+ ʵ�����п��ͭ���ã�п��������ʵ���������п���ã�п����������ʵ���е��������෴ ˮ��Ʒ�� �缫���� ����
��������
��1��п������ˮ���γ�ԭ���ʱ������ʧ������������п��������
��2���γɵ�ԭ����У��ϻ��õĽ�����ʧ���Ӷ���������
��3������ͼ���н������缫�͵�ѹ�Ĺ�ϵ������
��4��������˵�ش��������������ѹ����
��1��ʵ��6�е缫������п�������ã���Ϊ��������ӦʽΪAl-3e-=Al3+��
��2��ʵ��1��п��ͭ���ã�пΪ������ʵ��5������п���ã�пΪ����������ʵ���е��������෴��
��3����ʵ��1��5��֪,ˮ����صĵ�ѹ��ˮ����Ʒ�ּ��缫�����йء�
��4��������˵�ش��������������ѹ���ٽӷ�������ܣ�������������

 һ����ʦ�����Ծ�ϵ�д�
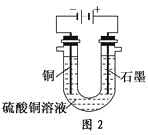
һ����ʦ�����Ծ�ϵ�д�����Ŀ������������(NOx)�Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2��ijͬѧ��ʵ�����ж�NH3��NOx��Ӧ������̽�����ش��������⣺
��1���������Ʊ�

�ٰ����ķ���װ�ÿ���ѡ����ͼ�е�________����Ӧ�Ļ�ѧ����ʽΪ______________��
��Ԥ�ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã�������˳��Ϊ������װ����______(������������Сд��ĸ��ʾ)��
��2����������������ķ�Ӧ�������ռ�����NH3����ע����X�У�Ӳ�ʲ�����Y�м�����������������NO2(�����ü���K1��K2�к�)����һ���¶��°�ͼʾװ�ý���ʵ�顣

�������� | ʵ������ | ����ԭ�� |
��K1���ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y����_____________ | �ڷ�Ӧ�Ļ�ѧ����ʽ ____________ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | ��_______________ | ��______________ |
����Ŀ��������[(CH3COO)2Ni]��һ����Ҫ�Ļ���ԭ�ϡ�һ���Ժ�������(��NiS�� Al2O3��FeO��CaO��SiO2 )Ϊԭ�ϣ���ȡ�������Ĺ�������ͼ���£�
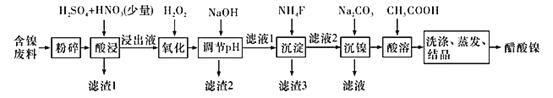
��������������������pH��������ʵ��ܽ��������
�������� | ��ʼ������pH | ������ȫ��pH | ���� | 20��ʱ���ܽ���(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | �� |
Fe2+ | 5.8 | 8.8 | NiF2 | ���� |
Al3+ | 3.0 | 5.0 | CaF2 | ���� |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60��10-6 |
(1)���麬�����ϵ�������__________��
(2)��������У�1molNiSʧȥ6NA�����ӣ�ͬʱ����������ɫ�ж����塣д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��
(3)д�����������м���H2O2������Ӧ�����ӷ���ʽ��________��
(4)����pH�������������У���ҺpH�ĵ��ڷ�Χ��________��
(5)����3��Ҫ�ɷֵĻ�ѧʽ��_________��
(6)���������У���c(Ni2+ )=2.0 mol��L-1����ʹ100 mL����Һ�е�Ni2+������ȫ[c(Ni2+)��10-5 mol��L-1]������Ҫ����Na2CO3�������������Ϊ___________g(����1λС��)��
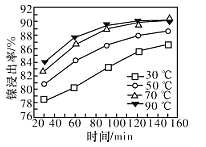
(7)���������������䣬�ڲ�ͬ�¶��¶Ժ������Ͻ������������������ʱ��仯��ͼ�����������¶���ʱ��ֱ�Ϊ______�桢_______min��