题目内容
4.合成氨是人类科学技术上的一项重大突破.工业上以天然气为原料合成氨.其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
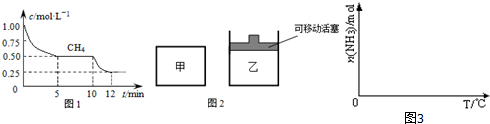
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示.反应中处于平衡状态的时间为5~10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.
在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
分析 (1)①处于平衡状态时,各组分的浓度保持不变;
10min时,改变的外界条件,瞬间甲烷浓度不变,而后减小,说明改变条件平衡正向移动;
②反应过程中温度不变,正反应为气体物质的量增大的反应,甲中压强增大,而乙中压强不变,甲等效为乙平衡的基础上增大压强,与乙中平衡相比逆向移动;
(2反应前后气体体积不变,用物质的量代替浓度计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而确定反应中正、逆反应速率的关系;
(3)①从通入原料气开始,随温度不断升高,开始阶段反应未到达平衡,NH3物质的量增大,到达平衡时NH3物质的量最大,而后升高温度,平衡逆向移动,NH3物质的量又减小;
②根据勒夏特列原理,增大压强或降低温度或分离液氨都有利于平衡正向移动,反应物转化率增大;
(4)在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,转化的氮气为2mol×50%=1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 4 0
转化量(mol):1 3 2
平衡量(mol):1 1 2
①平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,则转化的氮气小于1mol.
解答 解:(1)①由图可知,5~10min、12min后甲烷的浓度均不发生变化,处于平衡状态;
10min时,改变的外界条件,瞬间甲烷浓度不变,不能是改变压强,而后甲烷浓度减小,说明改变条件平衡正向移动,正反应为放热反应,可能是升高温度,
故答案为:5~10min、12min后;升高温度;
②反应过程中温度不变,正反应为气体物质的量增大的反应,甲中压强增大,而乙中压强不变,甲等效为乙平衡的基础上增大压强,与乙中平衡相比逆向移动,则α甲(CH4)<α乙(CH4),
故答案为:<;
(2反应前后气体体积不变,用物质的量代替浓度计算浓度商Qc=$\frac{2×2}{0.5×8.5}$=0.94<K=1,反应向正反应进行,故v(正)>v(逆),
故选:a;
(3)①从通入原料气开始,随温度不断升高,开始阶段反应未到达平衡,NH3物质的量增大,到达平衡时NH3物质的量最大,而后升高温度,平衡逆向移动,NH3物质的量又减小,随温度不断升高,NH3物质的量变化的曲线示意图为: ,
,
故答案为: ;
;
②根据勒夏特列原理,增大压强或降低温度或分离液氨都有利于平衡正向移动,反应物转化率增大,
故答案为:增大压强或降低温度或分离液氨;
(4)在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,转化的氮气为2mol×50%=1mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 4 0
转化量(mol):1 3 2
平衡量(mol):1 1 2
①平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(\frac{2}{10})^{2}}{\frac{1}{10}×(\frac{1}{10})^{3}}$=400,故答案为:400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,则转化的氮气小于1mol,故反应放出的热量<92.4kJ,故答案为:<.
点评 本题考查化学平衡计算与影响因素、平衡状态特征、平衡常数计算及应用,是对学生综合能力考查,难度中等.

| A. | CO2 | B. | N2 | C. | H2 | D. | O2 |
| A. | 0.1g | B. | 0.01g | C. | 0.001g | D. | 0.0001g |
V3++VO2++H2O
 VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )| A. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| B. | 放电时正极反应为:VO+2+2H++e-=VO2++H2O | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电过程中,H+由阴极区移向阳极区迁移 |
| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:5 |
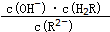 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”) 溴化钙用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.工业上利用海水和贝壳为原料制备CaBr2•2H2O的主要流程如下:
溴化钙用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.工业上利用海水和贝壳为原料制备CaBr2•2H2O的主要流程如下: