题目内容
19.全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O
 VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )| A. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| B. | 放电时正极反应为:VO+2+2H++e-=VO2++H2O | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电过程中,H+由阴极区移向阳极区迁移 |
分析 根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析:
A、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,根据化合价判断转移的电子数;
B、原电池放电时,VO2+离子化合价降低,被还原,应是电源的正极反应,生成VO2+离子;
C、原电池放电时,电子由负极经外电路移向正极,内电路由溶液中离子的定向移动形成闭合回路;
D、充电过程中,H+由阳极区移向阴极区迁移.
解答 解:A、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,每转移2mol电子时,消耗2mol氧化剂,故A错误;
B、原电池放电时,VO2+离子化合价降低,被还原,应是电源的正极反应,生成VO2+离子,反应的方程式为VO2++2H++e-=VO2++H2O,故B正确;
C、原电池放电时,电子由负极经外电路移向正极,内电路由溶液中离子的定向移动形成闭合回路,故C错误;
D、充电过程中,H+由阳极区移向阴极区迁移,故D错误.
故选B.
点评 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.25℃时,某溶液中含有Na+、H+、Fe3+、HCO3-、OH-、I-中的几种离子,已知由水电离出的C(H+)=1×10-13mol•L-1.向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色.下列关于该溶液的分析,错误的是( )
| A. | pH=1或pH=13 | |
| B. | 阴离子肯定没有I -,不能确定有无HCO3- | |
| C. | 阳离子肯定没有Fe3+,不能确定有无Na+ | |
| D. | 溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH |
10.下列化学用语表述正确的是( )
| A. | 水分子的结构式: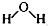 | B. | 氯化钠的电子式: | ||
| C. | 氯气的比例模型: | D. | 硫原子的结构示意图: |
7.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在一定温度的密闭容器中充入2molSO2 和1molO2充分反应,达到平衡状态时最终放出的热量为98.32kJ,则平衡时容器中的压强与起始时压强的比值为( )
| A. | $\frac{3}{2}$ | B. | $\frac{2}{3}$ | C. | $\frac{6}{5}$ | D. | $\frac{5}{6}$ |
4.合成氨是人类科学技术上的一项重大突破.工业上以天然气为原料合成氨.其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示.反应中处于平衡状态的时间为5~10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是a(填序号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
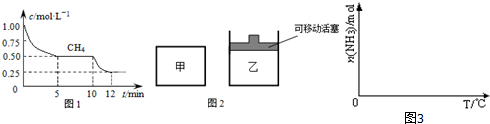
①依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.
在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示.反应中处于平衡状态的时间为5~10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.
在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
11.下列叙述中正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | B. | 水泥、玻璃、水晶属于硅酸盐材料 | ||
| C. | Na2O2的热稳定性大于NaHCO3 | D. | 金属钠着火时可用泡沫灭火器灭火 |
9.在一盛有22.4L(标准状况下)CO2和CO混合气体的密闭容器中投入1molNa2O2固体,用间断的电火花引发至恰好完全反应,下列对反应完全后容器里剩余固体的叙述正确的是( )
| A. | 1molNa2CO3 | B. | 0.5molNa2CO3,0.5 molNa2O2 | ||
| C. | 0.25molNa2CO3,0.75 molNa2O2 | D. | O.75 molNa2CO3,0.25 molNa2O2 |
 ,该物质分子中所含的官能团有氨基、羧基(填写名称).
,该物质分子中所含的官能团有氨基、羧基(填写名称).