题目内容
16.下列反应的离子方程式书写正确的是( )| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
分析 A.二氧化硫少量,生成亚硫酸铵溶液;
B.碘离子还原性强于二价铁离子,氯气先氧化碘离子;
C.漏掉铵根离子与氢氧根离子的反应;
D.二氧化碳过量反应生成次氯酸、碳酸氢钙.
解答 解:A.氨水吸收少量的二氧化硫,离子方程式:2NH3•H2O+SO2=2NH4++SO32-+2H2O,故A错误;
B.FeI2溶液中通入Cl2至Fe2+恰好完全被氧化,离子方程式:4I-+2Fe2++3Cl2→2Fe3++2I2+6Cl-,故B错误;
C.碳酸氢铵溶液中加入过量氢氧化钠溶液,离子方程式:NH4++HCO3-+2OH-→CO32-+H2O+NH3•H2O,故C错误;
D.在Ca(ClO)2溶液中通入足量的CO2气体,离子方程式:ClO-+CO2+H2O→HClO+HCO3-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式应遵循客观事实、遵循原子个数、电荷数守恒规律,注意反应为用量对反应影响,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
6.配制一定物质的量浓度的某溶液,下列情况会使配置结果偏低的是( )
| A. | 未冷却就转移、定容 | B. | 未洗涤烧杯及玻璃棒 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 容量瓶原有少量蒸馏水 |
7.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在一定温度的密闭容器中充入2molSO2 和1molO2充分反应,达到平衡状态时最终放出的热量为98.32kJ,则平衡时容器中的压强与起始时压强的比值为( )
| A. | $\frac{3}{2}$ | B. | $\frac{2}{3}$ | C. | $\frac{6}{5}$ | D. | $\frac{5}{6}$ |
4.合成氨是人类科学技术上的一项重大突破.工业上以天然气为原料合成氨.其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
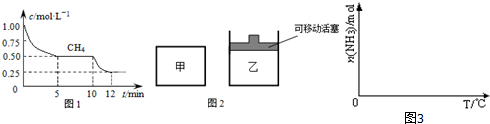
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示.反应中处于平衡状态的时间为5~10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是a(填序号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.
在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示.反应中处于平衡状态的时间为5~10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.
在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
11.下列叙述中正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | B. | 水泥、玻璃、水晶属于硅酸盐材料 | ||
| C. | Na2O2的热稳定性大于NaHCO3 | D. | 金属钠着火时可用泡沫灭火器灭火 |
1.下列离子方程式正确的是( )
| A. | 氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | NaHCO3溶液中加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
 ,该物质分子中所含的官能团有氨基、羧基(填写名称).
,该物质分子中所含的官能团有氨基、羧基(填写名称). ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);