题目内容
13.若表为周期表的一部分,其中M的单质与水反应时,水作还原剂,下列说法正确的是( )| Y | X | M | ||
| Z | W |
| A. | 最低价离子半径Y、X、M依次减小 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 工业上通过电解Z的氯化物来冶炼Z单质 | |
| D. | Y、W、X三种元素最低价氢化物的沸点依次升高 |
分析 M的单质与水反应时,水作还原剂,则M为F元素,可推知X为O元素、Y为N元素、W为P元素、Z为Al元素,
A.电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.X、Y和H形成的化合物中可能含有离子键,可能只含共价键;
C.Z是Al元素,工业上采用电解熔融氧化铝冶炼Al;
D.氢化物的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高;
据此解答.
解答 解:M的单质与水反应时,水作还原剂,则M为F元素,可推知X为O元素、Y为N元素、W为P元素、Z为Al元素.
A.Y、X、M最低价离子的电子层结构相同的离子,核电荷数越大离子半径越小,故最低价离子半径Y、X、M依次减小,故A正确;
B.由X、Y和氢三种元素形成的化合物中,硝酸铵含有离子键、共价键,故B错误;
C.氯化铝属于共价化合物,熔融状态下不导电,工业上电解熔融氧化铝冶炼Al,故C错误;
D.水常温下为液态,而NH3、PH3为气态,氨气分子之间存在氢键,沸点高于PH3,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断M为F元素是解题关键,注意对基础知识的理解掌握,易错选项是C,注意铝不能电解熔融氯化铝冶炼.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 组成单质的分子内一定含有共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
4.常温下,0.1mol•L-1下列溶液的pH<7的是( )
| A. | CuSO4 | B. | 氨水 | C. | NaNO3 | D. | NaHCO3 |
1.下列说法正确的是( )
| A. | 常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 | |
| B. | T℃时,pH=6的纯水中,含10-8NA个OH-(NA表示阿伏加德罗常数) | |
| C. | 将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 | |
| D. | 常温下由水电离的c(H+)=1×10-13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
8.某同学弄清氨的喷泉实验原理后有了一个创新的设计:如果改换烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验.下列各组中的气体和液体不符合该学生设计的一组是( )
| A. | HCl和水 | B. | CO2和NaOH溶液 | C. | NO和水 | D. | Cl2和NaOH溶液 |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
5.下列有关化学用语表示正确的是( )
| A. | 四氯化碳分子比例模型: | B. | COS的电子式是: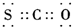 | ||
| C. | 次氯酸的结构式为H-Cl-O | D. | ${\;}_{8}^{18}$O2-离子结构示意图: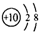 |
2.以下化学反应的离子方程式书写正确的是( )
| A. | H2CO3电离:H2CO3?2H++CO32- | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | C12溶解于水:H2O+Cl2?2H++ClO-+Cl- | |
| D. | 向CuSO4溶液中通入H2S:Cu2++H2S═CuS↓+2H+ |
3.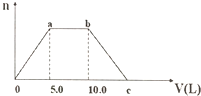 向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )
向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )
 向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )
向Ba(OH)2和NaOH的混合溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,下列说法不正确的是( )| A. | a点之前的反应化学方程式为:CO2+Ba(OH)2=BaCO3↓+H2O | |
| B. | a~b之间的反应离子方程式为:CO2+2OH-=CO${\;}_{3}^{2-}$+H2O | |
| C. | c点CO2的体积应为15.0L | |
| D. | 原混合溶液中Ba(OH)2和NaOH的浓度之比为1:1 |