题目内容
9.下列说法正确的是( )| A. | 室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 为保护地下钢管不受腐蚀,可将它与直流电源的负极相连 |
分析 A.室温下,pH=2的醋酸浓度大于pH=12的NaOH溶液浓度,二者等体积混合醋酸有剩余;
B.室温下,加水稀释醋酸促进醋酸电离,其它离子浓度减小,但溶液中c(OH-)增大;
C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,抑制BaSO4溶解;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护.
解答 解:A.室温下,pH=2的醋酸浓度大于pH=12的NaOH溶液浓度,二者等体积混合醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度,导致溶液呈酸性,故A错误;
B.室温下,加水稀释醋酸促进醋酸电离,醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故B错误;
C.向含有BaSO4沉淀的溶液中加入Na2SO4固体,抑制BaSO4溶解,所以溶液中c(Ba2+)减小,故C错误;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护,为保护地下钢管不受腐蚀,可使其与直流电源负极相连,故D正确;
故选D.
点评 本题考查强弱电解质、沉淀溶解平衡、离子浓度大小比较、金属腐蚀与防护,侧重考查学生分析问题能力,明确溶液中的溶质及其性质是解本题关键,利用守恒思想、弱电解质电离影响因素等知识点解答即可,题目难度不大.

练习册系列答案
相关题目
19.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀.已知有关物质的溶度积KSP(25℃)如下:
下列论述错误的是( )
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
17.短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
| A. | 在地壳中,C元素的含量位于第一位 | |
| B. | 由B、C、D三种元素组成的盐只有两种 | |
| C. | C元素位于元素周期表中的第3周期第ⅠA族 | |
| D. | B元素与氢元素形成化合物的化学式一定为H2B |
4.常温下,0.1mol•L-1下列溶液的pH<7的是( )
| A. | CuSO4 | B. | 氨水 | C. | NaNO3 | D. | NaHCO3 |
14.下列电子式书写正确的是( )
| A. | NaCl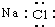 | B. | OH-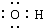 | C. | HCl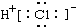 | D. | Na2O2 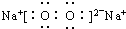 |
1.下列说法正确的是( )
| A. | 常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 | |
| B. | T℃时,pH=6的纯水中,含10-8NA个OH-(NA表示阿伏加德罗常数) | |
| C. | 将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 | |
| D. | 常温下由水电离的c(H+)=1×10-13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
19.下列说法正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 | |
| C. | 汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
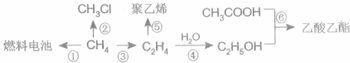
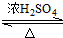 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;