题目内容
10.下列叙述正确的是( )| A. | 第三周期元素形成的简单离子中半径最小的是Na+ | |
| B. | 同周期元素(过渡元素和0族元素除外)从左到右,原子半径逐渐减小 | |
| C. | 带ⅦA族元素从上到小,其氢化物的稳定性逐渐增强 | |
| D. | 同主族元素从上到下,单质的熔点逐渐降低 |
分析 A.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.同一周期元素,原子半径随着原子序数增大而减小;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.碱金属族元素单质的熔沸点随着原子序数增大而减小;卤族元素单质的熔沸点随着原子序数增大而增大.
解答 解:A.离子电子层数越多,其半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小,第三周期移动离子半径先减小后增大,离子半径最小的是Al3+,故A错误;
B.同一周期元素,原子核对电子的吸引力随着原子序数增大而增大,所以原子半径随着原子序数增大而减小,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,卤族元素非金属性随着原子序数增大而减弱,所以其氢化物的稳定性随着原子序数增大而减弱,故C错误;
D.碱金属族元素单质的熔沸点随着原子序数增大而减小;卤族元素单质的熔沸点随着原子序数增大而增大,故D错误;
故选B.
点评 本题考查元素周期律,侧重考查学生分析判断能力,知道同一周期、同一主族元素原子结构及其性质递变规律即可解答,易错选项是A,注意离子半径大小比较方法.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.下列说法正确的是( )
| A. | 常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 | |
| B. | T℃时,pH=6的纯水中,含10-8NA个OH-(NA表示阿伏加德罗常数) | |
| C. | 将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 | |
| D. | 常温下由水电离的c(H+)=1×10-13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
5.下列有关化学用语表示正确的是( )
| A. | 四氯化碳分子比例模型: | B. | COS的电子式是: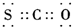 | ||
| C. | 次氯酸的结构式为H-Cl-O | D. | ${\;}_{8}^{18}$O2-离子结构示意图: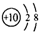 |
15.下列分值中,所有原子的最外层均满足8电子稳定结构的是( )
| A. | PCl5 | B. | N2 | C. | BF3 | D. | H2O |
2.以下化学反应的离子方程式书写正确的是( )
| A. | H2CO3电离:H2CO3?2H++CO32- | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | C12溶解于水:H2O+Cl2?2H++ClO-+Cl- | |
| D. | 向CuSO4溶液中通入H2S:Cu2++H2S═CuS↓+2H+ |
19.下列说法正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 | |
| C. | 汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
20.在溶液中能大量共存的微粒组是( )
| A. | K+、CH3COOH、CO32-、NO3- | B. | Fe3+、Na+、SCN-、Cl- | ||
| C. | Ba2+、Na+、OH-、HCO3- | D. | H+、K+、Fe3+、NO3- |
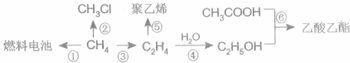
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;