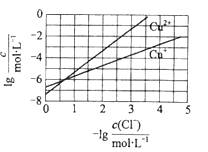
题目内容
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:
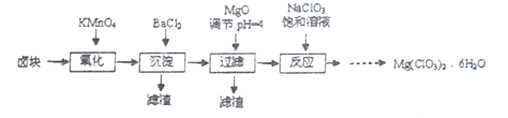
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
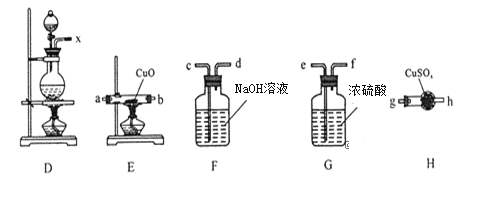
(1)过滤所需要的主要玻璃仪器有_________。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________;______;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______。(保留到小数点后一位)
【答案】 烧杯、漏斗、玻璃棒 Fe(OH)3 MgCl2+2NaC1O3=Mg(C1O3)2+2NaCl↓ 蒸发浓缩或蒸发结晶 趁热过滤 ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O 78.3%
【解析】本题是一道无机物质制取的工艺流程题,解答此类题目必须弄懂每一步流程中发生的反应和物质的转化关系。
(1)过滤所需要的主要玻璃仪器有:烧杯、漏斗、玻璃棒。
(2)加KMnO4的目的是氧化Fe2+使其转化为Fe3+,再加入BaCl2除去SO42-, 此时溶液中的溶质主要为MgCl2、FeCl3, Fe3+发生水解:Fe3++3H2O![]() Fe(OH)3+3HCl,加入的MgO与水解得到的H+反应,促使上述平衡正向移动从而使Fe3+转化为Fe(OH)3沉淀而与MgCl2分离,故加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3。
Fe(OH)3+3HCl,加入的MgO与水解得到的H+反应,促使上述平衡正向移动从而使Fe3+转化为Fe(OH)3沉淀而与MgCl2分离,故加MgO后过滤所得滤渣的主要成分的化学式为Fe(OH)3。
(3)过滤后的溶液中的溶质为MgCl2,加入NaClO3后生成的NaCl的溶解度小,在饱和溶液中以沉淀的形式析出,故反应可以发生,化学方程式为:MgCl2+2NaC1O3=Mg(C1O3)2+2NaCl↓;
加入NaClO3后生成Mg(C1O3)2溶液和NaCl沉淀,可以先将混合物蒸发浓缩,使更多的NaCl沉淀析出,由于Mg(C1O3)2的溶解度随温度的降低而降低,同时为了减少Mg(C1O3)2的析出,必须在较高温度下过滤,得到Mg(C1O3)2滤液,洗涤沉淀得到NaCl产品。最后对滤液进行冷却结晶,得到Mg(ClO3)2·6H2O晶体。故答案为:蒸发浓缩或蒸发结晶、趁热过滤。
(4)①ClO3-具有氧化性,Fe2+具有还原性,两者在酸性条件中反应,离子方程式为: ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O ;②根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,K2Cr2O7溶液滴定的Fe2+的物质的量为6×0.100×15.00×10-3mol=9×10-3mol,所以ClO3-消耗的Fe2+的物质的量为20×10-3mol-9×10-3mol=0.011mol,根据ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O可得ClO3-的物质的量为0.011/6mol,所以原100ml样品溶液中ClO3-的物质的量为0.011/6mol×10=0.11/6mol,Mg(ClO3)2·6H2O的物质的量为0.11/12mol,质量为(0.11/12)×299g,故Mg(ClO3)2·6H2O的质量分数为(0.11/12)×299g÷3.5×100%=78.3%。

【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5 kJ/mol
②2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol
③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7 kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:__________。
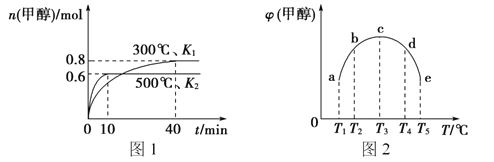
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
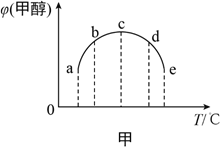
①温度升高甲醇的体积分数增大的原因是__________.
②根据图像判断ΔH__________(填“>”、“<”或“=”)0。
(3)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9 kJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | A | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=__________;反应温度T1__________T2(填“大于”或“小于”。)
②容器Ⅱ中a=__________。
③下列说法能说明反应达到平衡状态的是__________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.混合气体中c(CH3OCH3)不变