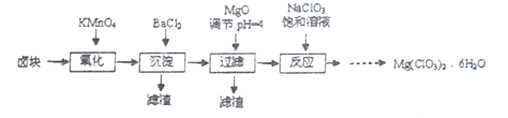
题目内容
【题目】下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)B是____________,W是__________。(填化学式)
(2)用单线桥法标出反应①电子转移的方向和数目:_________________。
(3)写出G与Cu在加热条件下能反应生成E和F的物质的量之比为1∶1的化学方程式:________________________________________________________________________。
(4)若W是酸式盐,_________g W加热分解的产物通过足量的Na2O2,固体Na2O2增重3g,则转移的电子总数为__________。
【答案】H2O NH4HCO3或(NH4)2CO3(答对任意一个给满分)![]() 2Cu+6HNO3
2Cu+6HNO3![]() 2Cu(NO3)2+NO↑+NO2↑+3H2O7.9g0.2NA
2Cu(NO3)2+NO↑+NO2↑+3H2O7.9g0.2NA
【解析】
W既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则A为NH3,气体C能与Na2O2反应,应是二氧化碳与过氧化钠反应,故C为CO2,则W应为碳酸铵或碳酸氢铵,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,(1)由上分析B为H2O;W应为(NH4)2CO3或者NH4HCO3;反应①是CO2与Na2O2反应生成Na2CO3和O2,用单线桥法标出反应电子转移的方向和数目为:![]() ;(3) G为HNO3,与Cu在加热条件下能反应生成NO和NO2的物质的量之比为1∶1的化学反应,根据氧化还原反应配平可得反应方程式为:2Cu+6HNO3
;(3) G为HNO3,与Cu在加热条件下能反应生成NO和NO2的物质的量之比为1∶1的化学反应,根据氧化还原反应配平可得反应方程式为:2Cu+6HNO3![]() 2Cu(NO3)2+NO↑+NO2↑+3H2O;(4) 若W是酸式盐则为NH4HCO3,NH4HCO3加热分解的产物为氨气、二氧化碳和水蒸气NH4HCO3
2Cu(NO3)2+NO↑+NO2↑+3H2O;(4) 若W是酸式盐则为NH4HCO3,NH4HCO3加热分解的产物为氨气、二氧化碳和水蒸气NH4HCO3![]() NH3↑+ CO2+H2O,该反应的产物通过足量的Na2O2,能与过氧化钠反应且使其增重的为二氧化碳和水,根据反应2CO2+2Na2O2= 2Na2CO3+O2、2H2O+2Na2O2= 4NaOH+O2↑,固体Na2O2增重3g,由于每摩二氧化碳可增重28g、每摩水可增重2g,则n(CO2+H2O)=
NH3↑+ CO2+H2O,该反应的产物通过足量的Na2O2,能与过氧化钠反应且使其增重的为二氧化碳和水,根据反应2CO2+2Na2O2= 2Na2CO3+O2、2H2O+2Na2O2= 4NaOH+O2↑,固体Na2O2增重3g,由于每摩二氧化碳可增重28g、每摩水可增重2g,则n(CO2+H2O)=![]() ,则分解NH4HCO3的为
,则分解NH4HCO3的为![]() ,质量为
,质量为![]() ;转移的电子总数为
;转移的电子总数为![]() 。
。

【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D