题目内容
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
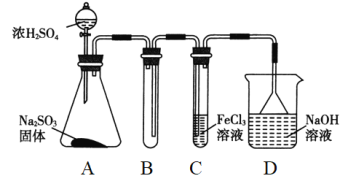
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为____________。C装置的作用_____________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
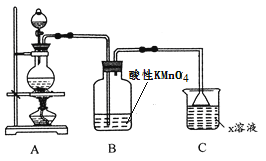
验证该气体的实验方案如下:
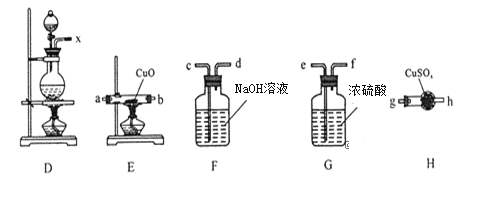
①装置连接顺序:X→ ___→___→___→___→a→b→_____;
②能证明上述假设成立的实验现象是_____________。
③某学习小组经过讨论认为该实验方案还不够严谨,你认为是否合理,若合理,则不作答,若不合理,请指出不严谨之处__________________________。
④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的某离子,可供选用的试剂: a、Cl2;b、Br2;c、稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填字母),反应的离子反应方程式为_________________________________________________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O吸收尾气,防止污染环境;防倒吸常温下,浓硫酸使Fe钝化H2x→c→d→e→f→a→b→gE中固体由黑色变红色,H中固体白色变蓝色应在h之后添加一个盛装碱石灰的球形干燥管C2Fe2++H2O2+2H+=2Fe3++2H2O
CuSO4+SO2↑+2H2O吸收尾气,防止污染环境;防倒吸常温下,浓硫酸使Fe钝化H2x→c→d→e→f→a→b→gE中固体由黑色变红色,H中固体白色变蓝色应在h之后添加一个盛装碱石灰的球形干燥管C2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】
(1)浓硫酸具有强氧化性,在加热条件下与Cu反应生成CuSO4、SO2和H2O,故化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;C装置的作用吸收尾气,防止污染环境、防倒吸;(2)若将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是常温下,浓硫酸使Fe钝化;在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,这是因为实验后阶段浓硫酸变为稀硫酸,稀硫酸与铁反应会产生氢气,故该气体可能为H2;①若要验证该气体是氢气,根据可供选择的装置及药品,先除去二氧化硫,再吸水干燥,然后通入灼热的氧化铜,最后检验产物是水,所以装置连接顺序:x→c→d→e→f→a→b→g;②若E中(硬质玻璃管)黑色粉末变红,说明生成了铜单质,同时H中(球形干燥管)固体由白色变为蓝色,说明生成了水,由此可证明上述假设成立;③有不严谨之处,应在h之后添加一个盛装碱石灰的球形干燥管;④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的亚铁离子,选项稀硫酸和H2O2时产物为水,无污染故合适试剂选项C,反应的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
CuSO4+SO2↑+2H2O;C装置的作用吸收尾气,防止污染环境、防倒吸;(2)若将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是常温下,浓硫酸使Fe钝化;在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,这是因为实验后阶段浓硫酸变为稀硫酸,稀硫酸与铁反应会产生氢气,故该气体可能为H2;①若要验证该气体是氢气,根据可供选择的装置及药品,先除去二氧化硫,再吸水干燥,然后通入灼热的氧化铜,最后检验产物是水,所以装置连接顺序:x→c→d→e→f→a→b→g;②若E中(硬质玻璃管)黑色粉末变红,说明生成了铜单质,同时H中(球形干燥管)固体由白色变为蓝色,说明生成了水,由此可证明上述假设成立;③有不严谨之处,应在h之后添加一个盛装碱石灰的球形干燥管;④若把D中的反应液倾倒入盛水的烧杯中,为氧化其中的亚铁离子,选项稀硫酸和H2O2时产物为水,无污染故合适试剂选项C,反应的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案