题目内容
10.下列有关热化学方程式及其叙述正确的是( )| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据燃烧热的概念分析判断,生成的一氧化碳不是稳定氧化物;
C、结合反应特征依据△H-T△S<0分析判断;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数.
解答 解:A、氢气燃烧热是放热反应,焓变为负值,其燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.5 kJ•mol-1,故A错误;
B、已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,生成的一氧化碳不是稳定氧化物,燃烧热是1molC燃烧生成稳定氧化物二氧化碳放出的热量,故B错误;
C、N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,△S<0,只有低温下符合△H-T△S<0,该反应不一定能自发进行,故C错误;
D、热化学方程式的化学计量数表示物质的量,可以是整数也可以是分数,故D正确;
故选D.
点评 本题考查了反应焓变、熵变与反应自发进行的判断依据,主要是书写方法和表达意义,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
18.对于平衡:2SO3(g)?2SO2(g)+O2(g)-Q(Q>0),符合右图变化情况的是( )
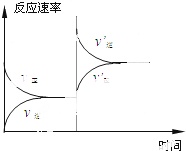

| A. | 加压 | B. | 增加O2的浓度 | ||
| C. | 使用催化剂 | D. | 同时增大SO3和O2的浓度 |
5.以下化学用语正确的是( )
| A. | 乙酸的最简式:CH2O | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 苯的结构式:C6H6 | D. | 四溴化碳的电子式: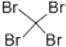 |
15. 氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )
氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )
 氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )
氯原子对O3分解有催化作用:Cl+O3=ClO+O2△H1;ClO+O=Cl+O2△H2.大气臭氧层的分解反应是:O+O3=2O2△H,该反应的能量变化示意图如图:下列叙述中,正确的是( )| A. | 反应O+O3=2O2的△H=E1-E3 | B. | O+O3=2O2是放热反应 | ||
| C. | △H=△H1+△H2 | D. | 反应O+O3=2O2的△H=E1-E2 |
2.用石墨作电极,电解1mol•L-1下列物质的水溶液,溶液的pH保持不变的是( )
| A. | NaOH | B. | HCl | C. | KCl | D. | Na2SO4 |
19.6.4g铜跟60mL 8mol/L的硝酸充分反应,硝酸的还原产物有NO、NO2.铜完全溶解后,测得溶液中H+的物质的量为n mol,此时溶液中所含NO${\;}_{3}^{-}$的物质的量为( )
| A. | (n+0.2)mol | B. | (n+0.4)mol | C. | 0.28 mol | D. | 0.31 mol |
20.溶液酸碱性探究题
25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11的碱(BOH)溶液.由于标签破损不知道是何种酸,测得该酸溶液的pH=3.为了进一步认识该酸,请你参与该兴趣小组同学设计实验方案.
(1)证明该一元酸是不是盐酸:
(2)探究HA是强酸还是弱酸:取上述HA和BOH的溶液各20mL混合后溶液的pH=5,试推测HA是强酸还是弱酸.你的结论是弱酸;如果酸是强酸,当体积相等时,pH=3的HA和pH=11的BOH反应只能是中性或碱性,而反应后溶液的pH=5为酸性,所以HA必为弱酸.
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计).则混合时酸和碱的体积之比为V(HA):V(BOH)=11:9.
(4)若HA是强酸,pH=a,BOH是强碱,pH=b,已知a+b=12,两种溶液混合后溶液pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的倍数关系是V(碱)100V(酸).
25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11的碱(BOH)溶液.由于标签破损不知道是何种酸,测得该酸溶液的pH=3.为了进一步认识该酸,请你参与该兴趣小组同学设计实验方案.
(1)证明该一元酸是不是盐酸:
| 滴加试剂 | 所根据的现象 | 结论 |
| 不是盐酸 |
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计).则混合时酸和碱的体积之比为V(HA):V(BOH)=11:9.
(4)若HA是强酸,pH=a,BOH是强碱,pH=b,已知a+b=12,两种溶液混合后溶液pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的倍数关系是V(碱)100V(酸).
 .
.