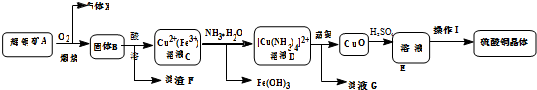
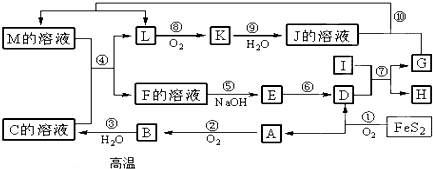
题目内容
20.如表标出的是元素周期表的一部分元素,回答下列问题: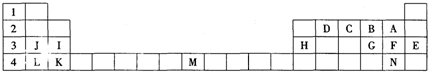
(1)表中用字母标出的14种元素中,化学性质最不活泼的是Ar(用元素符号表示,下同),金属性最强的是K,非金属性最强的是F,属于过渡元素的是Fe.
(2)字母为F的元素,最高价氧化物对应的水化物的化学式为HClO4.
(3)写出D的最高价氧化物电子式
 .
.(4)B和G的氢化物,沸点较高的是H2O(填化学式),原因是水中存在氢键.
(5)H、J两元素的最高价氧化物对应水化物相互反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
分析 根据元素周期表知,A、B、C、D、E、F、G、H、I、J、K、L、M、N分别是F、O、N、C、Ar、Cl、S、Al、Mg、Na、Ca、K、Fe、Br元素,
(1)元素周期表中,稀有气体元素原子最外层达到稳定结构,所以化学性质最不活泼,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角,但稀有气体除外,副族元素和第VIII族元素都属于过渡元素;
(2)Cl的最高价氧化物对应的水化物为高氯酸;
(3)C的最高价氧化物为二氧化碳,二氧化碳中C与O形成两对共价键;
(4)水中由于存在氢键,故熔沸点高;
(5)氢氧化铝为两性氢氧化物,与氢氧化钠反应生成偏铝酸钠和水.
解答 解:根据元素周期表知,A、B、C、D、E、F、G、H、I、J、K、L、M、N分别是F、O、N、C、Ar、Cl、S、Al、Mg、Na、Ca、K、Fe、Br元素,
(1)元素周期表中,稀有气体元素原子最外层达到稳定结构,所以化学性质最不活泼,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角,但稀有气体除外,副族元素和第VIII族元素都属于过渡元素,所以这14种元素中,化学性质最不活泼的元素是Ar,金属性最强的元素是K,非金属性最强的元素是F,属于过渡元素的是Fe,故答案为:Ar;K;F;Fe;
(2)F为Cl,形成的最高价氧化物的水化物为高氯酸,化学式为:HClO4,故答案为:HClO4;
(3)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故答案为:
,故答案为: ;
;
(4)由于水中存在氢键,故水的熔沸点高于硫化氢,故答案为:H2O;
(5)Al(OH)3与NaOH反应为Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝、水在离子反应中应保留化学式,则该离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表及其应用,把握元素在周期表的位置推断元素及元素的性质为解答的关键,注意非金属性、金属性的比较,题目难度不大.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 大理石与醋酸:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 碳酸氢钙溶液中加入石灰水:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O | |
| D. | 明矾溶于水:Al3++3H2O?Al(OH)3+3H+ |
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则其燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,则石墨的燃烧热为110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故该反应一定能自发进行 | |
| D. | 热化学方程式中的化学计量数表示物质的量,可以是分数 |