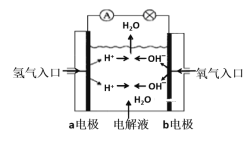
题目内容
【题目】常温下,向20mL 0.1 mol·L1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
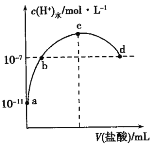
A. 常温下,0.1 mol·L1氨水中NH3·H2O的电离常数K约为1×10-6
B. a、b之间的点一定满足:c(NH4+) > c(Cl) > c(H+) > c(OH)
C. b、d点溶液中都满足c(NH4+)=c(Cl)
D. c点代表两溶液恰好完全反应
【答案】D
【解析】
A.常温下,0.1mol/L的氨水溶液中水电离的c(H+)=10-11mol/L,氨水溶液中H+全部来自水电离,则溶液中c(H+)=10-11mol/L,c(OH-)=![]() mol/L=10-3mol/L,Ka=
mol/L=10-3mol/L,Ka=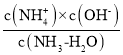 =
=![]() mol/L=1
mol/L=1![]() 10-5mol/L,A错误;
10-5mol/L,A错误;
B.a、b之间的任意一点,水电离的c(H+)<1×10-7mol/L,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),B错误;
C.根据上述分析,d点溶液中水电离的c(H+)=10-7mol/L,此时溶液中溶质为NH4Cl和HCl,溶液呈酸性,c(NH4+)<c(Cl),C错误;
D.根据图知,c点水电离的H+达到最大,溶液中溶质为NH4Cl,恰好完全反应,D正确;
答案为D。

【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
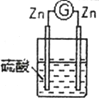
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
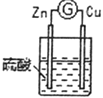
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。