题目内容
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
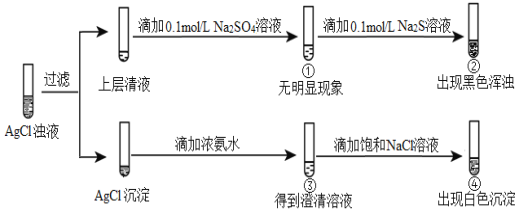
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
【答案】A
【解析】
0.1mol/L AgNO3溶液和0.1mol/L NaCl溶液等体积混合得到浊液,说明生成氯化银沉淀;向①的溶液中滴加 0.1 mol/L Na2S溶液,出现浑浊,此实验说明①的溶液中仍然存在银离子,同时说明硫化银比Ag2SO4更难溶;取少量氯化银沉淀,滴加氨水,发生反应![]() ,沉淀逐渐溶解,若向③中滴加一定量的硝酸,氨水浓度减小,
,沉淀逐渐溶解,若向③中滴加一定量的硝酸,氨水浓度减小,![]() 平衡逆向移动;
平衡逆向移动;
根据上述分析,向①的滤液中滴加0.1 mol/L Na2S溶液,出现浑浊,此实验说明①的溶液中仍然存在银离子,故A错误;向①的溶液中滴加 0.1 mol/L Na2S溶液,出现浑浊,此实验说明硫化银比Ag2SO4更难溶,故B正确;取少量氯化银沉淀,滴加氨水,发生反应![]() ,沉淀逐渐溶解,故C正确;若向③中滴加一定量的硝酸,氨水浓度减小,
,沉淀逐渐溶解,故C正确;若向③中滴加一定量的硝酸,氨水浓度减小,![]() 平衡逆向移动,出现氯化银沉淀,故D正确。
平衡逆向移动,出现氯化银沉淀,故D正确。

练习册系列答案
相关题目







