题目内容
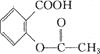
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。实验室要制备K3[Fe(C2O4)3]·3H2O并测定![]() 的含量。请回答下列相关问题。
的含量。请回答下列相关问题。
I.FeC2O4·2H2O的制备
向烧杯中加入5.0g(NH4)2Fe(SO4)2·6H2O、15mL蒸馏水、1mL3moL/L的硫酸,加热溶解后加入25mL饱和H2C2O4溶液,继续加热并搅拌一段时间后冷却,将所得FeC2O4·2H2O晶体过滤、洗涤。
(1)制备FeC2O4·2H2O时,加入3mol/L硫酸的作用是________________________。
II.K3[Fe(C2O4)3]·3H2O的制备
向I中制得的FeC2O4·2H2O晶体中加入10mL饱和K2C2O4溶液,水浴加热至40℃,缓慢加入过量3%的H2O2溶液并不断搅拌,溶液中产生红褐色沉淀,H2O2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H2C2O4溶液使红褐色沉淀溶解。向溶液中再加入10mL无水乙醇,过滤、洗涤、干燥。
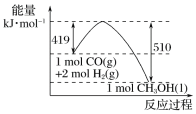
(2)制备过程中有两个反应会生成K3[Fe(C2O4)3],两个化学方程式依次是:______________________、2Fe(OH)3+3K2C2O4+3H2C2O4=2K3[Fe(C2O4)3]+6H2O。
(3)H2O2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。
III.![]() 含量的测定
含量的测定
称取0.22gⅡ中制得的K3[Fe(C2O4)3]·3H2O晶体于锥形瓶中,加入50mL蒸馏水和15mL3mol/L的硫酸,用0.02000mol/L的标准KMnO4溶液滴定,重复3次实验平均消耗的KMnO4溶液体积为25.00mL。
(4)滴定时KMnO4溶液应盛放在_____________(填仪器名称)中,判断滴定终点的依据是_________________。
(5)滴定终点时,所得溶液中的溶质除硫酸外,还有__________________________(写化学式),K3[Fe(C2O4)3]·3H2O样品中![]() 的质量分数是____________________。
的质量分数是____________________。
【答案】抑制![]() 的水解(答案合理即可)
的水解(答案合理即可) ![]() 分解过量的
分解过量的![]() (答案合理即可) 酸式滴定管 最后一滴标准
(答案合理即可) 酸式滴定管 最后一滴标准![]() 溶液滴入后,溶液变为浅红色且
溶液滴入后,溶液变为浅红色且![]() 不再改变
不再改变 ![]() 50%
50%
【解析】
(1)制备![]() 时,加入
时,加入![]() 硫酸的作用是抑制
硫酸的作用是抑制![]() 的水解;
的水解;
(2)根据信息第一个生成K3[Fe(C2O4)3]的化学方程式是![]() ;
;
(3)为避免其干扰后续实验,可将混合物加热煮沸,使过量的![]() 分解;
分解;
(4)![]() 溶液有强氧化性,会腐蚀橡胶;
溶液有强氧化性,会腐蚀橡胶;
(5)草酸根被氧化生成二氧化碳,高锰酸根离子中的![]() 被还原生成
被还原生成![]() ,所以溶液中除过量硫酸外,还有
,所以溶液中除过量硫酸外,还有![]() 和
和![]() ;由题给数据计算可得。
;由题给数据计算可得。
(1)(NH4)2Fe(SO4)2为强酸弱碱盐,NH4+、![]() 在溶液中水解使溶液成酸性,加入少量的稀硫酸可以抑制Fe2+的水解,有利于FeC2O4·2H2O的制备,故答案为:抑制Fe2+的水解;
在溶液中水解使溶液成酸性,加入少量的稀硫酸可以抑制Fe2+的水解,有利于FeC2O4·2H2O的制备,故答案为:抑制Fe2+的水解;
(2)由题给信息可知,FeC2O4和K2C2O4在40℃条件下与双氧水反应生成K3[Fe(C2O4)3]和氢氧化铁沉淀,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)由于加入了过量的![]() ,为避免其干扰后续实验,可将混合物加热煮沸,使过量的
,为避免其干扰后续实验,可将混合物加热煮沸,使过量的![]() 分解,故答案为:分解过量的
分解,故答案为:分解过量的![]() ;
;
(4)![]() 溶液有强氧化性,会腐蚀橡胶,应盛放在酸式滴定管中;当完全反应时,再滴入一滴酸性高锰酸钾溶液,溶液会变为浅红色,且半分钟不褪色,故答案为:酸式滴定管;最后一滴标准
溶液有强氧化性,会腐蚀橡胶,应盛放在酸式滴定管中;当完全反应时,再滴入一滴酸性高锰酸钾溶液,溶液会变为浅红色,且半分钟不褪色,故答案为:酸式滴定管;最后一滴标准![]() 溶液滴入后,溶液变为浅红色且
溶液滴入后,溶液变为浅红色且![]() 不再改变;
不再改变;
(5)草酸根被氧化生成二氧化碳,高锰酸根离子中的![]() 被还原生成
被还原生成![]() ,所以溶液中除过量硫酸外,还有
,所以溶液中除过量硫酸外,还有![]() 和
和![]() 三种溶质;由题意可知,
三种溶质;由题意可知,![]() 晶体中
晶体中![]() 的质量为
的质量为![]() ,则
,则![]() 的质量分数为
的质量分数为![]() ×100%=50%,故答案为:
×100%=50%,故答案为:![]() 、
、![]() ;50%。
;50%。

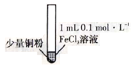
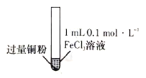
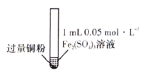
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下表所示,下列说法错误的是
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有利余、溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
D.实验Ⅱ、Ⅲ中加入蒸溜水后c(Cu2+)相同