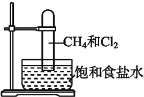
题目内容
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向NaHS溶液中加入盐酸产生大量气泡 | 氯的非金属性强于硫 |
B | 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液中一定含 |
C | 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 | 铜的活泼性强于铁 |
D | 常温下测得CH3COONH4溶液pH=7 | 相同温度下CH3COOH和NH3·H2O电离常数相同 |
A.AB.BC.CD.D
【答案】D
【解析】
A.判断非金属性可以通过最高价氧化物水化物的酸性强弱,不能通过无氧酸的酸性强弱判断,故A错误;
B.向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀,原溶液中可能有![]() 、
、![]() 等离子,不一定含有
等离子,不一定含有![]() ,故B错误;
,故B错误;
C.将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡是因为常温下铁遇到浓硝酸发生钝化阻碍了铁的反应,而铜与浓硝酸反应,不活泼金属铜做负极,活泼金属铁做正极,故C错误;
D.常温下测得![]() 溶液的
溶液的![]() ,说明
,说明![]() 和
和![]() 水解常数相同,水解程度相同,则
水解常数相同,水解程度相同,则![]() 和
和![]() 电离常数也相同,故D正确;
电离常数也相同,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下表所示,下列说法错误的是
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有利余、溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
D.实验Ⅱ、Ⅲ中加入蒸溜水后c(Cu2+)相同
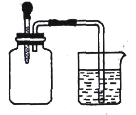
【题目】用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图所示:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |

(1)写出该反应的离子方程式__________________________________________。
(2)该实验探究的是________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是______>______(填实验序号)。
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______ mol·L-1(假设混合溶液的体积为50mL)。
(4)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_________________________来比较化学反应速率。
(5)小组同学发现反应速率变化如图,其中t1-t2时间内速率变快的主要原因可能是:①反应放热,②___________________。