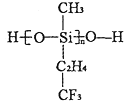
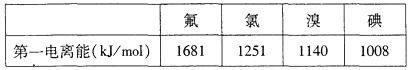
题目内容
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
【答案】NH3·H2O![]() NH4++OH- 4NH3+5O2
NH4++OH- 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O ![]() 酸性 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) HSO3-+ H+== SO2↑+ H2O H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强。 B
酸性 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) HSO3-+ H+== SO2↑+ H2O H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强。 B
【解析】
E原子的最外层电子数比次外层少2个,E的次外层,只能是L层,容纳8个电子,最外层则有6个电子,E为S元素,则C为O元素。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。BA3为NH3,则B元素为N,A元素为H。A和D同主族,根据D的原子序数比O大,则D为Na。
(1)氨气溶于水后生成NH3·H2O,会电离出OH-使溶液呈现碱性,答案为NH3·H2O![]() NH4++OH-;氨气连续两次氧化,为工业制取硝酸的流程。NH3氧化到NO,NO再氧化成NO2,NO2和水反应生成硝酸。甲生成乙的反应为4NH3+5O2
NH4++OH-;氨气连续两次氧化,为工业制取硝酸的流程。NH3氧化到NO,NO再氧化成NO2,NO2和水反应生成硝酸。甲生成乙的反应为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)D2C2为Na2O2,用电子式表示Na2O2的形成过程,,其表达式为![]() ;
;
(3)DAEC3和DAEC4的溶液分别为NaHSO3溶液和NaHSO4溶液。NaHSO3溶液中,HSO3-既电离又水解,HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,但是电离程度大于水解程度,因此溶液呈现酸性。NaHSO4为强酸的酸式根离子,NaHSO4=Na++H++SO42-,溶液呈酸性,则两者均为酸性。NaHSO3溶液中,NaHSO3=Na++HSO3-,HSO3-既电离又水解,则c(Na+) >c(HSO3-);HSO3-电离程度大于水解程度,忽略水解,HSO3-
H2SO3+OH-,但是电离程度大于水解程度,因此溶液呈现酸性。NaHSO4为强酸的酸式根离子,NaHSO4=Na++H++SO42-,溶液呈酸性,则两者均为酸性。NaHSO3溶液中,NaHSO3=Na++HSO3-,HSO3-既电离又水解,则c(Na+) >c(HSO3-);HSO3-电离程度大于水解程度,忽略水解,HSO3-![]() H++SO32-,溶液中还存在水的电离,H2O
H++SO32-,溶液中还存在水的电离,H2O![]() H++OH-,则c(H+)>c(SO32-);另电解质的电离程度一般大于水的电离程度,c(SO32-)>c(OH-);综上有c(Na+) >c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。将两种溶液混合,则HSO3-会与H+反应,方程式为HSO3-+ H+== SO2↑+ H2O;
H++OH-,则c(H+)>c(SO32-);另电解质的电离程度一般大于水的电离程度,c(SO32-)>c(OH-);综上有c(Na+) >c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。将两种溶液混合,则HSO3-会与H+反应,方程式为HSO3-+ H+== SO2↑+ H2O;
(4)H2SO3和H2SO4的结构式分别为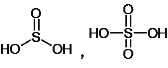 ,亚硫酸中只有1个非羟基氧原子,而硫酸中有2个非羟基氧原子。非羟基氧原子是吸电子原子,使得羟基中的电子更加偏向O,使氢原子更容易电离,酸性变强。此外硫酸中S的化合价更高,吸电子能力更强,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;答案为H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;
,亚硫酸中只有1个非羟基氧原子,而硫酸中有2个非羟基氧原子。非羟基氧原子是吸电子原子,使得羟基中的电子更加偏向O,使氢原子更容易电离,酸性变强。此外硫酸中S的化合价更高,吸电子能力更强,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;答案为H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;
(5)BCl3为NCl3。
A.NCl3分子中的中心原子N和Cl原子之间形成3个极性键,N原子的周围仍然存在一对孤电子对,故N原子的杂化方式为sp3杂化,A项正确,不符合题意;
B.NCl3分子中不含H原子,分子间只有分子间作用力,不含有氢键。B项错误,符合题意;
C.N元素和O元素同周期,同周期非金属元素的电负性从左到右,依次增强,则N的电负性小于O的电负性。基态N原子的价电子排布为2s22p3,基态O原子的价电子排布为2s22p4。N原子的p轨道为半满结构,更加稳定,第一电离能更大;C项正确,不符合题意;
D.NCl3发生水解反应,化学方程式为NCl3+3H2O=NH3+3HClO,D项正确,不符合题意;
综上答案为B。

【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。