题目内容
【题目】下表列出了10种元素在元素周期表中的位置:
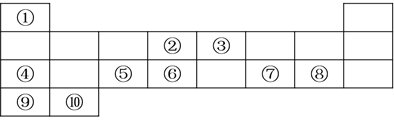
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第________________周期,第________________族;
(2)上述10种元素中,金属性最强的元素的符号为________________,最高价氧化物对应水化物中,酸性最强的物质的分子式为________________;
(3)②、③、⑥三种元素按原子半径由大到小的顺序排列为________________(用元素符号表示);
(4)④在空气中燃烧的化学方程式为________________;
(5)元素④、⑦的最高价氧化物对应水化物发生反应的离子方程式为________________;
(6)⑧与⑨形成的化合物的电子式为________________。
【答案】二 IVA K HClO4 Si>C>N 2Na+O2![]() 2Na2O2 H++OH―=H2O
2Na2O2 H++OH―=H2O ![]()
【解析】
根据周期表可知①为H,②为C,③为N,④为Na,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Ca;据此回答问题。
(1)元素②为C,是6号元素,位于周期表第二周期第IVA族;
(2)同周期从左向右金属性逐渐减弱,非金属性逐渐增强,同主族从上到下金属性逐渐增强,非金属性逐渐减弱,因此10种元素中,金属性最强的元素的符号为K,最高价氧化物对应水化物中,酸性最强的物质的分子式为HClO4;
(3)同周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,因此C、N、Si三种元素的原子半径由大到小的顺序为:Si>C>N;
(4)④为Na,在空气中燃烧生成过氧化钠,反应方程式为:2Na+O2![]() Na2O2;
Na2O2;
(5)④的最高价氧化物对应的水化物为NaOH,⑦的最高价氧化物对应的水化物为H2SO4,二者反应的方程式为2NaOH+H2SO4=Na2SO4+2H2O,离子方程式为:H++OH-=H2O;
(6)⑧为Cl,⑨为K,二者构成的化合物为KCl,属于离子化合物,其电子式为![]() 。
。

【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D