题目内容
20.下列热化学方程式或离子方程式正确的是( )| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
分析 A.燃烧热必须生成稳定的氧化物;
B.高锰酸钾具有强的氧化性,能够氧化二氧化硫;
C.亚硫酸氢根离子为弱酸的酸式根离子,不能拆;
D.次氯酸根具有强的氧化性,能够氧化二价铁离子.
解答 解:A.氢气燃烧生成液态水最稳定,而H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1中生成的气态水,故A错误;
B.用足量KMnO4溶液吸收SO2气体,发生氧化还原反应,离子方程式:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故B正确;
C.NH4HSO3溶液与足量NaOH溶液共热,离子方程式:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,故C错误;
D.NaClO溶液与FeCl2溶液混合发生氧化还原反应,离子方程式:2Fe2++ClO-+5H2O=2Fe(OH)3↓+4H++Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意燃烧热的概念及热化学方程式书写注意问题,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
10.化学与人类生活密切相关,对下列生活中的现象的解释不正确的是( )
| A. | “地沟油”危害健康,是因为脂肪酸油脂中的碳碳双键被破坏,不利健康 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土可用作水果保鲜制是因为高锰酸钾溶液可吸收水果释放的乙烯 | |
| C. | 废旧电池必须回收利用,是因为电池中的重金属等会严重污染土壤和水体 | |
| D. | 食品包装袋、食物保鲜膜通常用聚乙烯树脂,是因为聚乙烯树脂是无毒的高分子化合物 |
8.已知AgCl的溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),下列说法不正确的是( )
| A. | 除去溶液中Ag+加盐酸盐比硫酸盐好 | |
| B. | 加入H20,溶解平衡不移动 | |
| C. | 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| D. | 反应2AgCl+Na2S═Ag2S+2NaCl 说明溶解度:AgCl>Ag2S |
15.下列装置或操作能达到实验目的是( )
| A. | 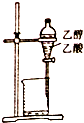 除去乙醇中的乙酸 | B. |  形成原电池 | ||
| C. | 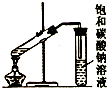 制取乙酸乙酯 | D. | 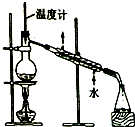 石油的蒸馏 |
5.下列叙述正确的是( )
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
4.NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
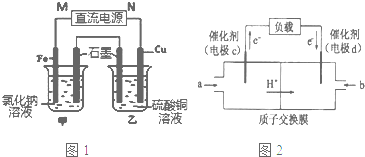
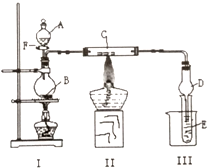 用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.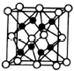 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题: