题目内容
【题目】为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中.如图所示仪器及药品试回答:
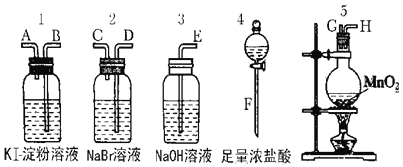
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接 ______ 、 ______ 接 ______ 、A接E.
(2)实验开始后装置5中反应的化学方程式为 ________________________ .
(3)装置3的作用是 ______ 反应的离子方程式为 ________________________ .
(4)装置1中产生的现象是 ______ 反应的离子方程式为 __________________ .
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为 ______________________________.
【答案】 D C B MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 吸收未反应完的Cl2,防止污染空气 Cl2+2OH-═Cl-+ClO-+H2O 溶液变蓝 Cl2+2I-═I2+2Cl- Cl2>Br2>I2
MnCl2+Cl2↑+2H2O 吸收未反应完的Cl2,防止污染空气 Cl2+2OH-═Cl-+ClO-+H2O 溶液变蓝 Cl2+2I-═I2+2Cl- Cl2>Br2>I2
【解析】(1)先制取氯气,然后将氯气通入NaBr溶液、再通入KI溶液检验氯气的强氧化性,氯气有毒不能排空,否则会污染大气,所以最后连接尾气处理装置,检验装置中导气管遵循“长进短出”原则,所以连接顺序是F接G、H接D、C接B、A接E,故答案为:D;C;B;
(2)实验开始后装置5中反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)二氧化硫有毒,不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以装置3的作用是吸收未反应完的Cl2,防止污染空气,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:吸收未反应完的Cl2,防止污染空气;Cl2+2OH-═Cl-+ClO-+H2O;
(4)氯气能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,所以看到的现象是溶液变蓝色,化学反应离子方程式为:Cl2+2I-═I2+2Cl-,故答案为:溶液变蓝;Cl2+2I-═I2+2Cl-;
(5)实验装置1,2的现象说明氯气和NaBr溶液、KI溶液发生反应,Cl2+2I-═I2+2Cl-,Cl2+2Br-=Br2+2Cl-,反应中Cl元素化合价由0价变为-1价、Br或I元素化合价由-1价变为0价,所以氯气作氧化剂、溴或碘单质作氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以Cl2的氧化性大于Br2>I2,已知溴离子的还原性弱于碘离子的还原性,说明Br2的氧化性大于I2,由此得出同主族元素随着原子序数的递增,元素非金属性逐渐减弱,单质氧化性逐渐减弱,Cl2>Br2>I2,故答案为:Cl2>Br2>I2。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
则0.1 mol/L的下列溶液中,c(H+)最大的是
A. HCNB. HFC. CH3COOHD. HNO2
