题目内容
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
【答案】 CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890kJ·mol-1 N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1 -488.3 kJ/mol 负 正 Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O 0.5mol
===Zn2++Mn2O3+2NH3+H2O 0.5mol
【解析】试题分析:I、(1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量;
(3)根据盖斯定律计算2C(s)+2H2(g)+O2(g)===CH3COOH(1)的焓变;
II、(1)原电池中负极发生氧化反应,正极发生还原反应;(2)电池总反应的离子方程式=正极反应式+负极反应式;(3)根据负极反应式计算消耗16.25gZn,电池中转移电子的物质的量。
解析:I、(1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890kJ·mol-1
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量;该反应的热化学方程式为N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
(3) 由题意可知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol ①
H2(g)+![]() O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l);ΔH=-870.3 kJ/mol ③
①×2+②×2-③即得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);ΔH=-488.3 kJ/mol;
II、(1)原电池中负极发生氧化反应,正极发生还原反应;(1)X是电池的负极,Y是电池的正极;(2)电池总反应的离子方程式=正极反应式+负极反应式,该电池总反应的离子方程式为:Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O;
===Zn2++Mn2O3+2NH3+H2O;
(3)
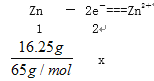
X=0.5mol

【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ⑥ | ④ | ⑤ | ⑦ | ⑩ | ⑧ | ⑨ |
⑴在这10种元素中,非金属性最强的元素是_____ (填“元素符号”);金属性最强的元素是_____(填“元素符号”);化学性质最不活泼的元素是_______(填“元素符号”);元素②简单离子的结构示意图为___________________。
⑵元素①与②中,原子半径较大的是________(填元素符号)。
⑶元素②与⑦的气态氢化物分别为__________和__________ (填化学式),两者的热稳定性大小为:前者_____后者。(填“>”、“<”或“=”)。
⑷元素④与⑧的最高价氧化物的水化物分别为______和______(填“化学式”),
两者反应的离子方程式为__________________________________。
⑸元素⑤的氧化物与盐酸反应的离子方程式为: _______________________。
⑹元素⑧的单质与元素⑩的氢化物反应的化学方程式为:__________________。
【题目】电镀工业会产生大量的电镀污水,处理某独酸性电镀废液(主要含Cu2+、Fe3 +)以制备氯化亚铜的工艺流程如图所示:

已知:① 氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。
② 常温下,
物质 | Fe(OH)3 | Cu(OH)2 |
Kap | 4.0×10-38 | 5.0×10-20 |
请回答下列问题:
(1)加H2SO4的步骤中,下列措施,可提高溶解速率的是_______(填序号)。
a.加热 b.增大压强 c.延长浸出时间 d.适当提高硫酸的浓度
(2)电镀污泥的主要成分是____,产品CuCl晶体要用无水乙醇洗涤、真空干燥、密封包装的目的是______________。
(3)加入H2SO4的目的是_________。
(4)亚硫酸钠、氯化钠、硫酸铜在溶液中反应生成CuCl的离子方程式为__________。
(5)实验探究pH对CuCl产率的影响如图 所示,当pH=2时CuCl 产率最大的原因是_________

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl。写出电解CuCl2溶液阴极的反应方程式:_______





