题目内容
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 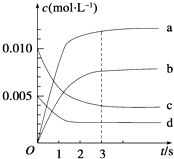
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
【答案】
(1)bc
(2)b
(3)0.0015mol?L﹣1?s﹣1
(4)ac
【解析】解:(1)a、当v (NO2)=2v (O2)时,该反应不一定达到平衡状态,故a错误; b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故b正确; c、v逆(NO):v正(O2)=2:1时,该反应达到平衡状态,所以当v逆(NO)=2v正(O2),该反应达到平衡状态,故c正确; d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;所以答案是:bc;(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020﹣0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)= ![]() ,故选b,所以答案是:b;(3)0~2s时,v(NO)=
,故选b,所以答案是:b;(3)0~2s时,v(NO)= ![]() =0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=
=0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)= ![]() v(NO)=0.0015molL﹣1s﹣1 , 所以答案是:0.0015molL﹣1s﹣1;(4)a.将容器体积变为1L,体积缩小相当于增大容器中的压强,压强增大,反应速率增大,平衡正向进行,故a正确;b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误; c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确; d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;所以答案是:a c.
v(NO)=0.0015molL﹣1s﹣1 , 所以答案是:0.0015molL﹣1s﹣1;(4)a.将容器体积变为1L,体积缩小相当于增大容器中的压强,压强增大,反应速率增大,平衡正向进行,故a正确;b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误; c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确; d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;所以答案是:a c.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡状态的判断,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等即可以解答此题.

【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
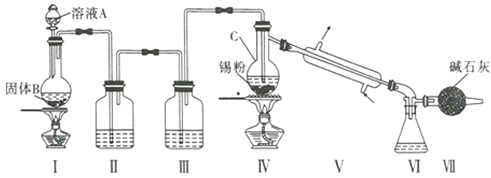
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)