题目内容
【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
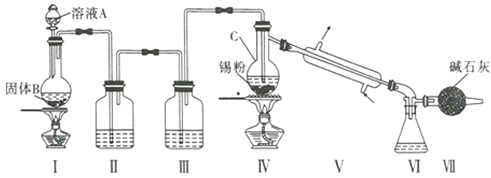
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)
【答案】 第5周期IVA族(全对才给分) 饱和食盐水 浓硫酸 吸收尾气中的氯气,防止污染空气 防止空气中的水蒸气进入装置V而使SnCl4水解 d MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 排除装置内的空气和少量的水汽(回答到“排空气”可给满分) SnCl4+(x+2)H2O==SnO2·xH2O↓+4HCl↑(写“
MnCl2+Cl2↑+2H2O 排除装置内的空气和少量的水汽(回答到“排空气”可给满分) SnCl4+(x+2)H2O==SnO2·xH2O↓+4HCl↑(写“![]() ”也可给分) 92.0
”也可给分) 92.0
【解析】(1)Sn与C同主族,核外有5个电子层,所以Sn在周期表中的位置:第5周期IVA族。
(2)I中二氧化锰与浓盐酸反应产生氯气,生成的氯气中含有挥发出的HCl和水蒸气,因为Sn能与HCl反应生成杂质SnCl2和SnCl4极易发生水解,所以IV中进入的氯气必须是纯净干燥的,故II中盛放饱和食盐水吸收HCl气体,III中盛放浓硫酸干燥氯气,因为SnCl4极易发生水解和多余的氯气有毒不能排放在空气中,所以VII有两个作用:吸收尾气中的氯气,防止污染空气和防止空气中的水蒸气进入装置V而使SnCl4水解。
(3)SnCl4和Cl2的沸点不同,当液态的SnCl4中溶有液态的Cl2时,可以根据两者的沸点不同,利用蒸馏法将两者分离,故答案选d。
(4)I中二氧化锰与浓盐酸反应产生氯气,对应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(5)加热Sn前先通氯气的作用是排除装置中少量的空气和水,防止生成的SnCl4发生水解。
(6)SnCl4发生水解时可以考虑先生成HCl和Sn(OH)4,然后S n(OH)4分解并生成SnO2·xH2O,对应的方程式为:SnCl4+(x+2)H2O==SnO2·xH2O↓+4HCl↑。
(7)5.95g锡粉的物质的量=5.95g÷119g·mol-1=0.05mol,所以理论上生成的SnCl4的物质的量也应为0.05mol,质量为0.05mol×251g· mol-1=13.05g,所以SnCl4的产率为12.0g/13.05g=0.920=92.0%。

【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 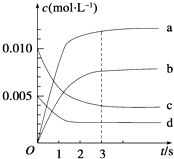
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
