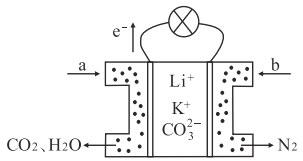
��Ŀ����
����Ŀ����ͼ��ʾ�ķ�Ӧ��ϵ�У����ֲ��ﱻ��ȥ����֪2mol��ɫ�����ĩX���ȷֽ⣬�ָ����������ɰ�ɫ����A����ɫҺ��B����ɫ����C��1mol��A��X��E��G��H����ɫ��Ӧ��Ϊ��ɫ����HΪ����ɫ���壮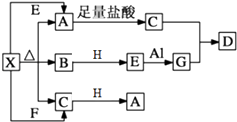
�ش��������⣺
��1��д���������ʵĻ�ѧʽ��X �� H ��
��2��д��E+Al��G��Ӧ�Ļ�ѧ����ʽ �� �÷�Ӧ���������� ��
��3��д��G��Һ��ͨ�����C��ȡD�ķ�Ӧ���ӷ���ʽ�� ��
��4��д��X��Һ�еμӹ�������ʯ��ˮ��Ӧ�����ӷ���ʽ�� ��
��5��0.1mol H��������C��Ӧ��ת�Ƶĵ�����Ϊ����
���𰸡�
��1��NaHCO3��Na2O2
��2��2Al+2NaOH+2H2O=2NaAlO2+3H2����H2O
��3��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3��
��4��HCO3��+Ca2++OH���TCaCO3��+H2O
��5��0.1NA
���������⣺A��X��E��G��H����ɫ��Ӧ��Ϊ��ɫ��������NaԪ�أ�HΪ����ɫ���壬��HΪNa2O2 �� X�ֽ�������ɫҺ��B����BΪH2O��B ![]() E
E ![]() G����֪EΪNaOH��GΪNaAlO2����ɫ����C��Na2O2��Ӧ���ɰ�ɫ����A��CΪCO2 �� A��Na2CO3 �� 2mol��ɫ�����ĩX���ȷֽ⣬���ɰ�ɫ����1molNa2CO3 �� 1molH2O��1molCO2 �� ����Ԫ���غ��֪��XΪNaHCO3 �� ��NaOH��Ӧ����Na2CO3 �� Na2CO3
G����֪EΪNaOH��GΪNaAlO2����ɫ����C��Na2O2��Ӧ���ɰ�ɫ����A��CΪCO2 �� A��Na2CO3 �� 2mol��ɫ�����ĩX���ȷֽ⣬���ɰ�ɫ����1molNa2CO3 �� 1molH2O��1molCO2 �� ����Ԫ���غ��֪��XΪNaHCO3 �� ��NaOH��Ӧ����Na2CO3 �� Na2CO3 ![]() CO2 �� CO2+NaAlO2��D��DΪAl��OH��3 �� ����ת����ϵ��NaHCO3+F��CO2 �� F������������εȣ���1����������ķ�����֪��XΪNaHCO3 �� HΪNa2O2 �� ���Դ��ǣ�NaHCO3��Na2O2����2��EΪNaOH��GΪNaAlO2 �� E+Al��G��Ӧ�Ļ�ѧ����ʽ 2Al+2NaOH+2H2O=2NaAlO2+3H2�����÷�Ӧ���������� H2O�����Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2����H2O����3��GΪNaAlO2 �� G��Һ��ͨ�����CO2��ȡAl��OH��3�ķ�Ӧ���ӷ���ʽΪAlO2��+CO2+2H2O�TAl��OH��3��+HCO3�� �� ���Դ��ǣ�AlO2��+CO2+2H2O�TAl��OH��3��+HCO3������4��XΪNaHCO3 �� X��Һ�еμӹ�������ʯ��ˮ��Ӧ�����ӷ���ʽΪHCO3��+Ca2++OH���TCaCO3��+H2O�����Դ��ǣ�HCO3��+Ca2++OH���TCaCO3��+H2O����5��CΪCO2 �� ��Na2O2��ӦΪ2Na2O2+2CO2=2Na2CO3+O2 �� ��Ӧ��OԪ�ػ��ϼ��ɩ�1�۽���Ϊ��2�ۣ��ɩ�1����Ϊ0�ۣ�Na2O2�������������ǻ�ԭ������ռ
CO2 �� CO2+NaAlO2��D��DΪAl��OH��3 �� ����ת����ϵ��NaHCO3+F��CO2 �� F������������εȣ���1����������ķ�����֪��XΪNaHCO3 �� HΪNa2O2 �� ���Դ��ǣ�NaHCO3��Na2O2����2��EΪNaOH��GΪNaAlO2 �� E+Al��G��Ӧ�Ļ�ѧ����ʽ 2Al+2NaOH+2H2O=2NaAlO2+3H2�����÷�Ӧ���������� H2O�����Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2����H2O����3��GΪNaAlO2 �� G��Һ��ͨ�����CO2��ȡAl��OH��3�ķ�Ӧ���ӷ���ʽΪAlO2��+CO2+2H2O�TAl��OH��3��+HCO3�� �� ���Դ��ǣ�AlO2��+CO2+2H2O�TAl��OH��3��+HCO3������4��XΪNaHCO3 �� X��Һ�еμӹ�������ʯ��ˮ��Ӧ�����ӷ���ʽΪHCO3��+Ca2++OH���TCaCO3��+H2O�����Դ��ǣ�HCO3��+Ca2++OH���TCaCO3��+H2O����5��CΪCO2 �� ��Na2O2��ӦΪ2Na2O2+2CO2=2Na2CO3+O2 �� ��Ӧ��OԪ�ػ��ϼ��ɩ�1�۽���Ϊ��2�ۣ��ɩ�1����Ϊ0�ۣ�Na2O2�������������ǻ�ԭ������ռ ![]() ��0.1molNa2O2��ȫ��Ӧת�Ƶ������ʵ���Ϊ0.1mol��
��0.1molNa2O2��ȫ��Ӧת�Ƶ������ʵ���Ϊ0.1mol�� ![]() ��2=0.1mol��ת�Ƶ�����ĿΪ��0.1mol��NAmol��1=0.1NA �� ���Դ��ǣ�0.1NA ��
��2=0.1mol��ת�Ƶ�����ĿΪ��0.1mol��NAmol��1=0.1NA �� ���Դ��ǣ�0.1NA ��

����Ŀ����2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��2NO2��g����H��0����ϵ�У�n��NO����ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����
a��v��NO2��=2v��O2�� b��������ѹǿ���ֲ���
c��v����NO��=2v����O2�� d�����������ʵ��ܶȱ��ֲ���
��2��ͼ�б�ʾNO2�ı仯�������� �� 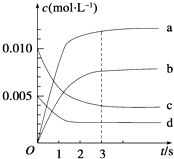
��3����O2��Ũ�ȱ仯��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v= ��
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����
a�������������Ϊ1Lb���ʵ������¶�c������O2��Ũ��d��ѡ���Ч�Ĵ�����